Χολίνη

Η χολίνη είναι ένα απαραίτητο θρεπτικό συστατικό για τον άνθρωπο και πολλά άλλα ζώα.[1] Η χολίνη εμφανίζεται ως κατιόν που σχηματίζει διάφορα άλατα (το X − στον απεικονιζόμενο τύπο είναι ένα απροσδιόριστο αντιανιόν). Για διατήρηση της υγείας, πρέπει να λαμβάνεται από τη διατροφή ως χολίνη ή ως φωσφολιπίδια χολίνης, όπως η φωσφατιδυλοχολίνη.[1] Οι άνθρωποι, όπως και τα περισσότερα άλλα είδη ζώων, παράγουν χολίνη de novo. Ωστόσο, η παραγωγή είναι γενικά ανεπαρκής. Η χολίνη συχνά δεν ταξινομείται ως βιταμίνη, αλλά ως θρεπτικό συστατικό με μεταβολισμό που μοιάζει με αμινοξέα.[2] Στα περισσότερα ζώα, τα φωσφολιπίδια χολίνης είναι απαραίτητα συστατικά στις κυτταρικές μεμβράνες, στις μεμβράνες των κυτταρικών οργανιδίων και σε λιποπρωτεΐνες πολύ χαμηλής πυκνότητας.[1] Η χολίνη απαιτείται για την παραγωγή της ακετυλοχολίνης – ενός νευροδιαβιβαστή – και της S-αδενοσυλομεθειονίνης (SAM), ενός παγκόσμιου δότη μεθυλίου. Κατά τη μεθυλίωση το SAM μετατρέπεται σε ομοκυστεΐνη.
Η συμπτωματική έλλειψη χολίνης – σπάνια στους ανθρώπους – προκαλεί μη αλκοολική λιπώδη νόσο του ήπατος και μυϊκή βλάβη.[1] Υπερβολική κατανάλωση χολίνης (πάνω από 7,5 g/ημέρα) μπορεί να προκαλέσει χαμηλή αρτηριακή πίεση, εφίδρωση, διάρροια και μυρωδιά που μοιάζει με ψάρι λόγω της τριμεθυλαμίνης, η οποία σχηματίζεται στο μεταβολισμό της.[1][3] Πλούσιες διατροφικές πηγές χολίνης και φωσφολιπιδίων χολίνης περιλαμβάνουν τα όργανα ζώων και τους κρόκους αυγών, γαλακτοκομικά προϊόντα, φιστίκια, ορισμένα φασόλια, ξηρούς καρπούς, σπόρους και λαχανικά με ζυμαρικά και ρύζι που συμβάλλουν επίσης στην πρόσληψη χολίνης στην αμερικανική διατροφή.[1][4]
Χημεία
[Επεξεργασία | επεξεργασία κώδικα]
Οι χολίνες είναι μια οικογένεια υδατοδιαλυτών ενώσεων τεταρτοταγούς αμμωνίου.[5][6] Η χολίνη είναι η μητρική ένωση της κατηγορίας των χολινών, που αποτελείται από μια αιθανολαμίνη που έχει τρεις μεθυλ υποκαταστάτες συνδεδεμένους στην αμινομάδα.[7] Το υδροξείδιο της χολίνης είναι γνωστό ως βάση χολίνης. Είναι υγροσκοπικό και έτσι συχνά συναντάται ως άχρωμο παχύρρευστο ενυδατωμένο σιρόπι που μυρίζει τριμεθυλαμίνη (TMA). Τα υδατικά διαλύματα χολίνης είναι σταθερά, αλλά η ένωση διασπάται αργά σε αιθυλενογλυκόλη, πολυαιθυλενογλυκόλες και TMA.[8]
Η χλωριούχος χολίνη μπορεί να παραχθεί με επεξεργασία TMA με 2-χλωροαιθανόλη:[8]
- (CH3)3 N + ClCH2CH2OH → (CH3)3N+CH2CH2OH · Cl –
Η 2-χλωροαιθανόλη μπορεί να παραχθεί από αιθυλενοξείδιο. Η χολίνη έχει παραχθεί ιστορικά από φυσικές πηγές, όπως μέσω υδρόλυσης λεκιθίνης.[8]
Μεταβολισμός
[Επεξεργασία | επεξεργασία κώδικα]Βιοσύνθεση
[Επεξεργασία | επεξεργασία κώδικα]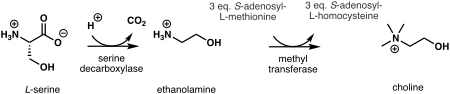
Στα φυτά, το πρώτο βήμα στη de novo βιοσύνθεση της χολίνης είναι η αποκαρβοξυλίωση της σερίνης σε αιθανολαμίνη, η οποία καταλύεται από μια αποκαρβοξυλάση σερίνης.[9] Η σύνθεση της χολίνης από την αιθανολαμίνη μπορεί να λάβει χώρα σε τρεις παράλληλες οδούς, όπου τρία διαδοχικά στάδια Ν -μεθυλίωσης καταλύονται από μια μεθυλοτρανσφεράση και πραγματοποιούνται είτε σε ελεύθερες βάσεις,[10] φωσφο-βάσεις,[11] ή βάσεις φωσφατιδυλίου.[12] Η πηγή της μεθυλομάδας είναι η S-αδενοσυλ-L-μεθειονίνη και η S-αδενοσυλ-L -ομοκυστεΐνη παράγεται ως παραπροϊόν.[13]
Στον άνθρωπο και στα περισσότερα άλλα ζώα, η de novo σύνθεση της χολίνης γίνεται μέσω της οδού της φωσφατιδυλαιθανολαμίνης Ν-μεθυλοτρανσφεράσης (PEMT),[3] αλλά η βιοσύνθεση δεν είναι αρκετή για να καλύψει τις ανάγκες ενός ανθρώπου.[14] Στην ηπατική PEMT, το 3-φωσφογλυκερικό (3PG) λαμβάνει 2 ακυλομάδες από το ακυλο-CoA σχηματίζοντας ένα φωσφατιδικό οξύ. Αντιδρά με την τριφωσφορική κυτιδίνη για να σχηματίσει διφωσφορική κυτιδίνη-διακυλογλυκερόλη. Η υδροξυλομάδα του αντιδρά με τη σερίνη για να σχηματίσει φωσφατιδυλοσερίνη η οποία αποκαρβοξυλιώνεται σε αιθανολαμίνη και σχηματίζεται φωσφατιδυλαιθανολαμίνη (PE). Ένα ένζυμο PEMT μετακινεί τρεις ομάδες μεθυλίου από τρεις S-αδενοσυλ μεθειονίνες (SAM) στην ομάδα αιθανολαμίνης της φωσφατιδυλαιθανολαμίνης για να σχηματίσει χολίνη με τη μορφή φωσφατιδυλοχολίνης. Τρεις S -αδενοσυλομοκυστεΐνες (SAHs) σχηματίζονται ως υποπροϊόν.[3]
Η χολίνη μπορεί επίσης να απελευθερωθεί από πιο πολύπλοκα μόρια που περιέχουν χολίνη. Για παράδειγμα, οι φωσφατιδυλοχολίνες (PC) μπορούν να υδρολυθούν σε χολίνη (Chol) στους περισσότερους κυτταρικούς τύπους. Η χολίνη μπορεί επίσης να παραχθεί μέσω της οδού CDP-χολίνης, οι κυτταροπλασματικές κινάσες χολίνης (CK) φωσφορυλιώνουν τη χολίνη με ATP σε φωσφοχολίνη (PChol).[2] Αυτό συμβαίνει σε ορισμένους τύπους κυττάρων όπως το συκώτι και τα νεφρά. Οι κυτιδυλυλοτρανσφεράσες χολίνης-φωσφορικής (CPCT) μετατρέπουν την PChol σε CDP-χολίνη (CDP-Chol) με τριφωσφορική κυτιδίνη (CTP). Η CDP-χολίνη και το διγλυκερίδιο μετασχηματίζονται σε PC από τη διακυλογλυκερολική χολινοφωσφοτρανσφεράση (CPT).[3]
Στους ανθρώπους, ορισμένες μεταλλάξεις του ενζύμου PEMT και η ανεπάρκεια οιστρογόνων (συχνά λόγω εμμηνόπαυσης) αυξάνουν τη διατροφική ανάγκη για χολίνη. Στα τρωκτικά, το 70% των φωσφατιδυλοχολινών σχηματίζεται μέσω της οδού PEMT και μόνο το 30% μέσω της οδού CDP-χολίνης.[3] Στα νοκ-άουτ ποντίκια, η αδρανοποίηση PEMT τα καθιστά πλήρως εξαρτημένα από τη διατροφική χολίνη.[2]
Απορρόφηση
[Επεξεργασία | επεξεργασία κώδικα]Στους ανθρώπους, η χολίνη απορροφάται από τα έντερα μέσω της μεμβρανικής πρωτεΐνης SLC44A1 (CTL1) μέσω διευκολυνόμενης διάχυσης που διέπεται από τη διαβάθμιση συγκέντρωσης χολίνης και το ηλεκτρικό δυναμικό στις μεμβράνες των εντεροκυττάρων. Η SLC44A1 έχει περιορισμένη ικανότητα μεταφοράς χολίνης: σε υψηλές συγκεντρώσεις μέρος της παραμένει μη απορροφήσιμο. Η απορροφημένη χολίνη φεύγει από τα εντεροκύτταρα μέσω της πυλαίας φλέβας, περνά από το ήπαρ και εισέρχεται στη συστηματική κυκλοφορία . Τα μικρόβια του εντέρου αποικοδομούν τη μη απορροφημένη χολίνη σε τριμεθυλαμίνη, η οποία οξειδώνεται στο ήπαρ σε Ν -οξείδιο της τριμεθυλαμίνης.[3]
Η φωσφοχολίνη και οι γλυκεροφωσφοχολίνες υδρολύονται μέσω φωσφολιπασών σε χολίνη, η οποία εισέρχεται στην πυλαία φλέβα. Λόγω της υδατοδιαλυτότητάς τους, μερικές από αυτά περνούν αμετάβλητες στην πυλαία φλέβα. Οι λιποδιαλυτές ενώσεις που περιέχουν χολίνη (φωσφατιδυλοχολίνες και σφιγγομυελίνες) είτε υδρολύονται από φωσφολιπάσες είτε εισέρχονται στη λέμφο ενσωματωμένες στα χυλομικρά.[3]
Μεταφορά
[Επεξεργασία | επεξεργασία κώδικα]Στους ανθρώπους, η χολίνη μεταφέρεται ως ελεύθερο μόριο στο αίμα. Τα φωσφολιπίδια που περιέχουν χολίνη και άλλες ουσίες, όπως οι γλυκεροφωσφοχολίνες, μεταφέρονται στις λιποπρωτεΐνες του αίματος. Τα επίπεδα χολίνης στο πλάσμα αίματος σε υγιείς ενήλικες σε νηστεία είναι 7–20 μικρογραμμομόρια ανά λίτρο (μmol/l) και 10 μmol/l κατά μέσο όρο. Τα επίπεδα ρυθμίζονται, αλλά η πρόσληψη και η ανεπάρκεια χολίνης μεταβάλλουν αυτά τα επίπεδα. Τα επίπεδα είναι ανυψωμένα για περίπου 3 ώρες μετά την κατανάλωση χολίνης. Τα επίπεδα φωσφατιδυλοχολίνης στο πλάσμα των ενηλίκων που νηστεύουν είναι 1,5–2,5 mmol/l. Η κατανάλωσή της ανεβάζει τα επίπεδα ελεύθερης χολίνης για περίπου 8-12 ώρες, αλλά δεν επηρεάζει σημαντικά τα επίπεδα φωσφατιδυλοχολίνης. [3]
Η χολίνη είναι ένα υδατοδιαλυτό ιόν και επομένως απαιτεί από τους μεταφορείς να περάσουν από τις λιποδιαλυτές κυτταρικές μεμβράνες. Τρεις τύποι μεταφορέων χολίνης είναι γνωστοί:[15]
- SLC5A7
- CTL: CTL1 (SLC44A1), CTL2 (SLC44A2) και CTL4 (SLC44A4)
- OCT: OCT1 (SLC22A1) και OCT2 ( SLC22A2)
Αποθήκευση
[Επεξεργασία | επεξεργασία κώδικα]Η χολίνη αποθηκεύεται στις κυτταρικές μεμβράνες και τα οργανίδια ως φωσφολιπίδια και μέσα στα κύτταρα ως φωσφατιδυλοχολίνες και γλυκεροφωσφοχολίνες.[3]
Απέκκριση
[Επεξεργασία | επεξεργασία κώδικα]Ακόμη και σε δόσεις χολίνης 2–8 g, λίγη χολίνη απεκκρίνεται στα ούρα στους ανθρώπους. Η απέκκριση γίνεται μέσω μεταφορέων που υπάρχουν στους νεφρούς. Η τριμεθυλγλυκίνη απομεθυλιώνεται στο ήπαρ και τα νεφρά σε διμεθυλγλυκίνη (το τετραϋδροφολικό λαμβάνει μία από τις μεθυλομάδες). Η μεθυλγλυκίνη σχηματίζεται, απεκκρίνεται στα ούρα ή απομεθυλιώνεται σε γλυκίνη.[3]
Λειτουργία
[Επεξεργασία | επεξεργασία κώδικα]Η χολίνη και τα παράγωγά της έχουν πολλές λειτουργίες στον άνθρωπο και σε άλλους οργανισμούς. Η πιο αξιοσημείωτη λειτουργία είναι ότι η χολίνη χρησιμεύει ως συνθετικός πρόδρομος για άλλα βασικά κυτταρικά συστατικά και μόρια σηματοδότησης, όπως τα φωσφολιπίδια που σχηματίζουν τις κυτταρικές μεμβράνες, τον νευροδιαβιβαστή ακετυλοχολίνη και τον ωσμορυθμιστή τριμεθυλγλυκίνη (βεταΐνη). Η τριμεθυλογλυκίνη με τη σειρά της χρησιμεύει ως πηγή μεθυλομάδων συμμετέχοντας στη βιοσύνθεση της S-αδενοσυλμεθειονίνης.[16][17]
Πρόδρομο φωσφολιπιδίων
[Επεξεργασία | επεξεργασία κώδικα]Η χολίνη μετασχηματίζεται σε διάφορα φωσφολιπίδια, όπως φωσφατιδυλοχολίνες και σφιγγομυελίνες. Αυτά βρίσκονται σε όλες τις κυτταρικές μεμβράνες και στις μεμβράνες των περισσότερων κυτταρικών οργανιδίων.[2] Οι φωσφατιδυλοχολίνες είναι δομικά σημαντικό μέρος των κυτταρικών μεμβρανών. Στους ανθρώπους το 40-50% των φωσφολιπιδίων τους είναι φωσφατιδυλοχολίνες.[3]
Τα φωσφολιπίδια χολίνης σχηματίζουν επίσης λιπιδικές σχεδίες στις κυτταρικές μεμβράνες μαζί με τη χοληστερόλη. Οι σχεδίες είναι κέντρα, για παράδειγμα για υποδοχείς και ένζυμα μεταγωγής σήματος υποδοχέων.[2]
Οι φωσφατιδυλοχολίνες χρειάζονται για τη σύνθεση της VLDL: 70–95% των φωσφολιπιδίων της είναι φωσφατιδυλοχολίνες στον άνθρωπο.[3]
Η χολίνη είναι επίσης απαραίτητη για τη σύνθεση του πνευμονικού επιφανειοδραστικού παράγοντα, ο οποίος είναι ένα μείγμα που αποτελείται κυρίως από φωσφατιδυλοχολίνες. Ο επιφανειοδραστικός παράγοντας είναι υπεύθυνος για την ελαστικότητα των πνευμόνων, δηλαδή για την ικανότητα του πνευμονικού ιστού να συστέλλεται και να διαστέλλεται. Για παράδειγμα, η ανεπάρκεια φωσφατιδυλοχολινών στους ιστούς των πνευμόνων έχει συνδεθεί με σύνδρομο οξείας αναπνευστικής δυσχέρειας.[18]
Οι φωσφατιδυλοχολίνες απεκκρίνονται στη χολή και συνεργάζονται με άλατα χολικού οξέος ως επιφανειοδραστικές ουσίες σε αυτήν, βοηθώντας έτσι στην εντερική απορρόφηση των λιπιδίων.[2]
Σύνθεση ακετυλοχολίνης
[Επεξεργασία | επεξεργασία κώδικα]Η χολίνη είναι απαραίτητη για την παραγωγή ακετυλοχολίνης. Αυτός είναι ένας νευροδιαβιβαστής που είναι απαραίτητος για τη σύσπαση των μυών, τη μνήμη και τη νευρική ανάπτυξη, για παράδειγμα.[3] Ωστόσο, υπάρχει λίγη ακετυλοχολίνη στο ανθρώπινο σώμα σε σχέση με άλλες μορφές χολίνης.[2] Οι νευρώνες αποθηκεύουν επίσης τη χολίνη με τη μορφή φωσφολιπιδίων στις κυτταρικές τους μεμβράνες για την παραγωγή ακετυλοχολίνης.[3]
Πηγή τριμεθυλογλυκίνης
[Επεξεργασία | επεξεργασία κώδικα]Στους ανθρώπους, η χολίνη οξειδώνεται μη αναστρέψιμα στα μιτοχόνδρια του ήπατος σε αλδεΰδη βεταΐνης γλυκίνης από οξειδάσες χολίνης. Αυτή οξειδώνεται από μιτοχονδριακές ή κυτοσολικές αφυδρογονάσες βεταΐνης-αλδεΰδης σε τριμεθυλγλυκίνη.[3] Η τριμεθυλγλυκίνη είναι ένας απαραίτητος ωσμορυθμιστής. Λειτουργεί επίσης ως υπόστρωμα για το ένζυμο BHMT, το οποίο μεθυλιώνει την ομοκυστεΐνη σε μεθειονίνη. Αυτή είναι πρόδρομο ένωση της S-αδενοσυλμεθειονίνης (SAM). Η SAM είναι ένα κοινό αντιδραστήριο στις βιολογικές αντιδράσεις μεθυλίωσης. Για παράδειγμα, μεθυλιώνει τις γουανιδίνες του DNA και ορισμένες λυσίνες ιστονών. Έτσι αποτελεί μέρος της γονιδιακής έκφρασης και της επιγενετικής ρύθμισης. Η ανεπάρκεια χολίνης οδηγεί έτσι σε αυξημένα επίπεδα ομοκυστεΐνης και μειωμένα επίπεδα SAM στο αίμα.[3]
Περιεκτικότητα σε τρόφιμα
[Επεξεργασία | επεξεργασία κώδικα]Η χολίνη εμφανίζεται στα τρόφιμα ως ελεύθερο μόριο και με τη μορφή φωσφολιπιδίων, ιδιαίτερα ως φωσφατιδυλοχολίνες. Η χολίνη έχει υψηλότερη συγκέντρωση στα οργάνων ζώων και στους κρόκους αυγών, αν και βρίσκεται επίσης σε μικρότερο βαθμό σε κρέατα, δημητριακά, λαχανικά, φρούτα και γαλακτοκομικά προϊόντα. Τα μαγειρικά έλαια και άλλα λίπη τροφίμων έχουν περίπου 5 mg/100 g ολικής χολίνης.[3] Στις Ηνωμένες Πολιτείες, οι ετικέτες τροφίμων εκφράζουν την ποσότητα χολίνης σε μια μερίδα ως ποσοστό της ημερήσιας αξίας (%DV) με βάση την επαρκή πρόσληψη 550 mg/ημέρα. Το 100% της ημερήσιας αξίας σημαίνει ότι μια μερίδα φαγητού έχει 550 mg χολίνης.
Το ανθρώπινο γάλα είναι πλούσιο σε χολίνη. Ο αποκλειστικός θηλασμός αντιστοιχεί σε περίπου 120 mg χολίνης την ημέρα για το μωρό. Η αύξηση της πρόσληψης χολίνης από τη μητέρα αυξάνει την περιεκτικότητα σε χολίνη του μητρικού γάλακτος και η χαμηλή πρόσληψη τη μειώνει.[3] Τα παρασκευάσματα για βρέφη μπορεί να περιέχουν ή να μην περιέχουν αρκετή χολίνη. Στην ΕΕ και τις ΗΠΑ, είναι υποχρεωτικό να προστεθούν τουλάχιστον 7 mg χολίνης ανά 100 χιλιοθερμίδες (kcal) σε κάθε βρεφικό γάλα. Στην ΕΕ, επίπεδα άνω του 50 mg/100 kcal δεν επιτρέπονται.[3][19]
Έλλειψη
[Επεξεργασία | επεξεργασία κώδικα]Η συμπτωματική ανεπάρκεια χολίνης είναι σπάνια στους ανθρώπους. Οι περισσότεροι λαμβάνουν επαρκείς ποσότητες από τη διατροφή και είναι σε θέση να βιοσυνθέσουν περιορισμένες ποσότητές της.[2] Η συμπτωματική ανεπάρκεια προκαλείται συχνά από ορισμένες ασθένειες ή από άλλες έμμεσες αιτίες. Η σοβαρή ανεπάρκεια προκαλεί μυϊκή βλάβη και μη αλκοολική λιπώδη νόσο του ήπατος, η οποία μπορεί να εξελιχθεί σε κίρρωση.[20]
Εκτός από τον άνθρωπο, το λιπώδες ήπαρ είναι επίσης τυπικό σημάδι ανεπάρκειας χολίνης σε άλλα ζώα. Αιμορραγία στα νεφρά μπορεί επίσης να εμφανιστεί σε ορισμένα είδη. Αυτό πιστεύεται ότι οφείλεται στην ανεπάρκεια τριμεθυλγλυκίνης που προέρχεται από χολίνη, η οποία λειτουργεί ως ωσμορυθμιστής.[2]
Η παραγωγή οιστρογόνων είναι ένας σημαντικός προδιαθεσικός παράγοντας για ανεπάρκεια χολίνης μαζί με χαμηλή διατροφική πρόσληψη χολίνης. Τα οιστρογόνα ενεργοποιούν τα ένζυμα PEMT που παράγουν φωσφατιδυλοχολίνη. Οι γυναίκες πριν από την εμμηνόπαυση έχουν χαμηλότερη διατροφική ανάγκη για χολίνη από τους άνδρες λόγω της υψηλότερης παραγωγής οιστρογόνων των γυναικών. Χωρίς θεραπεία με οιστρογόνα, οι ανάγκες σε χολίνη των μετεμμηνοπαυσιακών γυναικών είναι παρόμοιες με αυτές των ανδρών. Μερικοί μονονουκλεοτιδικοί πολυμορφισμοί (γενετικοί παράγοντες) που επηρεάζουν το μεταβολισμό της χολίνης και του φυλλικού οξέος είναι επίσης σχετικοί. Ορισμένα μικρόβια του εντέρου αποδομούν επίσης τη χολίνη πιο αποτελεσματικά από άλλα, επομένως είναι επίσης σχετικά.[20]
Σε περίπτωση ανεπάρκειας, η διαθεσιμότητα των φωσφατιδυλοχολινών στο ήπαρ μειώνεται - αυτές απαιτούνται για το σχηματισμό των VLDL. Έτσι η μεταφορά λιπαρών οξέων από το ήπαρ με τη μεσολάβηση της VLDL μειώνεται οδηγώντας σε συσσώρευση λίπους στο ήπαρ.[3] Άλλοι μηχανισμοί που εμφανίζονται ταυτόχρονα που εξηγούν την παρατηρούμενη ηπατική βλάβη έχουν επίσης προταθεί. Για παράδειγμα, τα φωσφολιπίδια χολίνης χρειάζονται επίσης στις μιτοχονδριακές μεμβράνες. Η μη διαθεσιμότητα τους οδηγεί στην αδυναμία των μιτοχονδριακών μεμβρανών να διατηρήσουν τη σωστή ηλεκτροχημική βαθμίδα, η οποία, μεταξύ άλλων, απαιτείται για την αποικοδόμηση των λιπαρών οξέων μέσω της β-οξείδωσης. Επομένως, ο μεταβολισμός του λίπους στο ήπαρ μειώνεται.[20]
Υπερβολική πρόσληψη
[Επεξεργασία | επεξεργασία κώδικα]Οι υπερβολικές δόσεις χολίνης μπορεί να έχουν δυσμενείς επιπτώσεις. Καθημερινά δόσεις 8–20 g χολίνης, για παράδειγμα, έχει βρεθεί ότι προκαλούν χαμηλή αρτηριακή πίεση, ναυτία, διάρροια και μυρωδιά σώματος που μοιάζει με ψάρι. Η οσμή οφείλεται στην τριμεθυλαμίνη (TMA) που σχηματίζεται από τα μικρόβια του εντέρου από τη μη απορροφημένη χολίνη (βλέπε τριμεθυλαμινουρία).[3]
Επιπτώσεις στην υγεία
[Επεξεργασία | επεξεργασία κώδικα]Κλείσιμο νευρικού σωλήνα
[Επεξεργασία | επεξεργασία κώδικα]Ορισμένες μελέτες σε ανθρώπους έδειξαν ότι η χαμηλή πρόσληψη χολίνης από τη μητέρα αυξάνει σημαντικά τον κίνδυνο ελαττωμάτων του νευρικού σωλήνα (NTDs) στα νεογνά. [1] Η έλλειψη φυλλικού οξέος προκαλεί επίσης NTDs. Η χολίνη και το φυλλικό οξύ, αλληλεπιδρώντας με τη βιταμίνη Β12, δρουν ως δότες μεθυλίου στην ομοκυστεΐνη για να σχηματίσουν μεθειονίνη, η οποία στη συνέχεια μπορεί να συνεχίσει να σχηματίζει SAM (S-αδενοσυλμεθειονίνη).[1] Η SAM είναι το υπόστρωμα για όλες σχεδόν τις αντιδράσεις μεθυλίωσης στα θηλαστικά. Έχει προταθεί ότι η διαταραγμένη μεθυλίωση μέσω της SAM θα μπορούσε να είναι υπεύθυνη για τη σχέση μεταξύ φυλλικού οξέος και NTD.[21] Αυτό μπορεί επίσης να ισχύει για τη χολίνη. Ορισμένες μεταλλάξεις που διαταράσσουν τον μεταβολισμό της χολίνης αυξάνουν τον επιπολασμό των NTD στα νεογνά, αλλά ο ρόλος της διατροφικής ανεπάρκειας χολίνης παραμένει ασαφής, όσον αφορά το 2015.[1]
Καρδιαγγειακά νοσήματα και καρκίνος
[Επεξεργασία | επεξεργασία κώδικα]Η ανεπάρκεια χολίνης μπορεί να προκαλέσει λιπώδες ήπαρ, το οποίο αυξάνει τον κίνδυνο καρκίνου και καρδιαγγειακών παθήσεων. Η ανεπάρκεια χολίνης μειώνει επίσης την παραγωγή SAM, η οποία συμμετέχει στη μεθυλίωση του DNA - αυτή η μείωση μπορεί επίσης να συμβάλει στην καρκινογένεση. Έτσι, έχει μελετηθεί η ανεπάρκεια και η συσχέτισή της με τέτοιες ασθένειες.[3] Ωστόσο, μελέτες παρατήρησης ελεύθερων πληθυσμών δεν έχουν δείξει πειστικά συσχέτιση μεταξύ της χαμηλής πρόσληψης χολίνης και των καρδιαγγειακών παθήσεων ή των περισσότερων μορφών καρκίνου.[1][3] Οι μελέτες για τον καρκίνο του προστάτη ήταν αντιφατικές.[22][23]
Νοητική λειτουργία
[Επεξεργασία | επεξεργασία κώδικα]Μελέτες που παρατηρούν την επίδραση μεταξύ της υψηλότερης πρόσληψης χολίνης και της νοητικής ικανότητας έχουν διεξαχθεί σε ανθρώπους ενήλικες, με αντιφατικά αποτελέσματα.[1][24] Παρόμοιες μελέτες σε βρέφη και παιδιά ήταν αντιφατικές και επίσης περιορισμένες.[1]
Χρήσεις
[Επεξεργασία | επεξεργασία κώδικα]Η χλωριούχος χολίνη και η διτρυγική χολίνη χρησιμοποιούνται σε συμπληρώματα διατροφής. Το διτρυγικό άλας χρησιμοποιείται συχνότερα λόγω της χαμηλότερης υγροσκοπικότητας του.[2] Ορισμένα άλατα χολίνης χρησιμοποιούνται για ως συμπληρώματα στο κοτόπουλο, τη γαλοπούλα και κάποιες άλλες ζωοτροφές. Ορισμένα άλατα χρησιμοποιούνται επίσης ως βιομηχανικά χημικά: για παράδειγμα, στη φωτολιθογραφία για την αφαίρεση φωτοανθεκτικού.[8] Η θεοφυλλινική χολίνη και η σαλικυλική χολίνη χρησιμοποιούνται ως φάρμακα,[8][25] καθώς και δομικά ανάλογα, όπως η μεθαχολίνη και η καρβαχόλη.[26] Οι ραδιοσημασμένες χολίνες, όπως η 11C-χολίνη, χρησιμοποιούνται στην ιατρική απεικόνιση.[27] Άλλα εμπορικά χρησιμοποιούμενα άλατα περιλαμβάνουν κιτρική τριχολίνη και διττανθρακική χολίνη.[8]
Ιστορία
[Επεξεργασία | επεξεργασία κώδικα]Το 1849, ο Άντολφ Στρέκερ ήταν ο πρώτος που απομόνωσε τη χολίνη από τη χολή του χοίρου.[28][29] Το 1852, οι Λ. Μπάμπο και M. Χίρσμπρουν εξήγαγαν χολίνη από σπόρους λευκής μουστάρδας και την ονόμασαν sinkaline.[29] Το 1862, ο Στρέκερ επανέλαβε το πείραμά του με τη χολή χοίρου και βοδιού, αποκαλώντας την ουσία χολίνη για πρώτη φορά, από την ελληνική λέξη χολή, και ταυτίζοντάς την με τον χημικό τύπο C5H13NO.[30][14] Το 1850, ο Τεοντόρ Νικολά Γκομπλέ εξήγαγε από τον εγκέφαλο και το αυγοτάραχο του κυπρίνου μια ουσία που ονόμασε λεκιθίνη από την ελληνική λέξη για τον κρόκο του αυγού, λήκυθος, δείχνοντας το 1874 ότι ήταν ένα μείγμα φωσφατιδυλοχολινών.[31][32]
Στις αρχές της δεκαετίας του 1930, ο Τσαρλς Μπεστ και οι συνεργάτες του σημείωσαν ότι το λιπώδες ήπαρ σε αρουραίους σε ειδική δίαιτα και διαβητικούς σκύλους θα μπορούσε να αποφευχθεί με τη διατροφή τους με λεκιθίνη[14] αποδεικνύοντας το 1932 ότι η χολίνη στη λεκιθίνη ήταν αποκλειστικά υπεύθυνη για αυτό το προληπτικό αποτέλεσμα.[33] Το 1998, η Εθνική Ακαδημία Ιατρικής των ΗΠΑ ανέφερε τις πρώτες συστάσεις για τη χολίνη στην ανθρώπινη διατροφή.[34]
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 «Choline». Micronutrient Information Center, Linus Pauling Institute, Oregon State University. Φεβρουαρίου 2015. Ανακτήθηκε στις 11 Νοεμβρίου 2019.
- ↑ 2,00 2,01 2,02 2,03 2,04 2,05 2,06 2,07 2,08 2,09 Handbook of vitamins (4th έκδοση). Taylor & Francis. 2007. σελίδες 459–477. ISBN 9780849340222.
- ↑ 3,00 3,01 3,02 3,03 3,04 3,05 3,06 3,07 3,08 3,09 3,10 3,11 3,12 3,13 3,14 3,15 3,16 3,17 3,18 3,19 3,20 3,21 3,22 «Dietary reference values for choline». EFSA Journal 14 (8). 2016. doi:.
- ↑ https://ods.od.nih.gov/factsheets/Choline-HealthProfessional/
- ↑ .
- ↑ Britannica, The Editors of Encyclopaedia. "choline". Encyclopedia Britannica, 11 Dec. 2013, https://www.britannica.com/science/choline. Accessed 17 February 2022.
- ↑ National Center for Biotechnology Information (2022). PubChem Compound Summary for CID 305, Choline. Retrieved February 17, 2022 from https://pubchem.ncbi.nlm.nih.gov/compound/Choline.
- ↑ 8,0 8,1 8,2 8,3 8,4 8,5 Kirk-Othmer encyclopedia of chemical technology. 6 (4th έκδοση). John Wiley & Sons. 2000. σελίδες 100–102. ISBN 9780471484943.
- ↑ «Plants synthesize ethanolamine by direct decarboxylation of serine using a pyridoxal phosphate enzyme». The Journal of Biological Chemistry 276 (38): 35523–9. September 2001. doi:. PMID 11461929.
- ↑ «Phosphatidylcholine synthesis in castor bean endosperm : free bases as intermediates». Plant Physiology 100 (3): 1527–35. November 1992. doi:. PMID 16653153. PMC 1075815. https://archive.org/details/sim_plant-physiology_1992-11_100_3/page/1527.
- ↑ «cDNA cloning of phosphoethanolamine N-methyltransferase from spinach by complementation in Schizosaccharomyces pombe and characterization of the recombinant enzyme». The Journal of Biological Chemistry 275 (19): 14095–101. May 2000. doi:. PMID 10799484.
- ↑ «Enhanced synthesis of choline and glycine betaine in transgenic tobacco plants that overexpress phosphoethanolamine N-methyltransferase». Proceedings of the National Academy of Sciences of the United States of America 98 (17): 10001–5. August 2001. doi:. PMID 11481443. Bibcode: 2001PNAS...9810001M.
- ↑ «Superpathway of choline biosynthesis». BioCyc Database Collection: MetaCyc. SRI International.
- ↑ 14,0 14,1 14,2 «A brief history of choline». Annals of Nutrition & Metabolism 61 (3): 254–8. 2012. doi:. PMID 23183298.
- ↑ «Functional Expression of Choline Transporters in the Blood-Brain Barrier». Nutrients 11 (10): 2265. September 2019. doi:. PMID 31547050.
- ↑ «Methyl nutrients, DNA methylation, and cardiovascular disease». Molecular Nutrition & Food Research 58 (1): 172–82. January 2014. doi:. PMID 23661599.
- ↑ «Dietary betaine promotes generation of hepatic S-adenosylmethionine and protects the liver from ethanol-induced fatty infiltration». Alcoholism, Clinical and Experimental Research 17 (3): 552–5. June 1993. doi:. PMID 8333583.
- ↑ «Abnormal liver phosphatidylcholine synthesis revealed in patients with acute respiratory distress syndrome». Journal of Lipid Research 59 (6): 1034–1045. June 2018. doi:. PMID 29716960.
- ↑ «21 CFR 107.100: Infant formula; Nutrient requirements; Nutrient specifications; Choline content». Code of Federal Regulations, Title 21; Food and Drug Administration. 1 Απριλίου 2019. Ανακτήθηκε στις 24 Οκτωβρίου 2019.
- ↑ 20,0 20,1 20,2 «Choline metabolism provides novel insights into nonalcoholic fatty liver disease and its progression». Current Opinion in Gastroenterology 28 (2): 159–65. March 2012. doi:. PMID 22134222.
- ↑ «Neural tube defects, folic acid and methylation». International Journal of Environmental Research and Public Health 10 (9): 4352–4389. 2013. doi:. PMID 24048206.
- ↑ «Choline intake and risk of lethal prostate cancer: incidence and survival». The American Journal of Clinical Nutrition 96 (4): 855–63. October 2012. doi:. PMID 22952174. PMC 3441112. https://archive.org/details/sim_american-journal-of-clinical-nutrition_2012-10_96_4/page/855.
- ↑ «Dietary choline and betaine intakes and risk of total and lethal prostate cancer in the Atherosclerosis Risk in Communities (ARIC) Study». Cancer Causes & Control 30 (4): 343–354. April 2019. doi:. PMID 30825046.
- ↑ «Dietary Choline Intake: Current State of Knowledge Across the Life Cycle». Nutrients 10 (10): 1513. October 2018. doi:. PMID 30332744.
- ↑ Community pharmacy: symptoms, diagnosis, and treatment (4th έκδοση). Elsevier. 2017. σελίδες 156. ISBN 9780702069970.
- ↑ «C2-Chlorocarbons to Combustion Technology». Kirk-Othmer encyclopedia of chemical technology. 6 (4th έκδοση). John Wiley & Sons. 2000. σελίδες 100–102. ISBN 9780471484943.
- ↑ «Diagnostic performance of choline PET/CT for the detection of bone metastasis in prostate cancer: A systematic review and meta-analysis». PLOS ONE 13 (9): e0203400. 2018. doi:. PMID 30192819. Bibcode: 2018PLoSO..1303400G.
- ↑ «Beobachtungen über die galle verschiedener thiere» (στα γερμανικά). Justus Liebigs Ann Chem 70 (2): 149–197. 1849. doi:. https://zenodo.org/record/1427022.
- ↑ 29,0 29,1 The vitamins. 3 (2nd έκδοση). Academic Press. 1971. σελίδες 4, 12. ISBN 9780126337631.
- ↑ «Üeber einige neue bestandtheile der schweinegalle» (στα γερμανικά). Justus Liebigs Ann Chem 123 (3): 353–360. 1862. doi:. https://zenodo.org/record/1427185.
- ↑ «Sur la lécithine et la cérébrine» (στα γαλλικά). J Pharm Chim 19 (4): 346–354. 1874. https://archive.org/details/journaldepharma26parigoog.
- ↑ «The discovery of lecithin, the first phospholipid». Bull Hist Chem 29 (1): 9–15. 2004. Αρχειοθετήθηκε από το πρωτότυπο στις 2019-04-13. https://web.archive.org/web/20190413044150/http://acshist.scs.illinois.edu/bulletin_open_access/v29-1/v29-1%20p9-15.pdf.
- ↑ «The effect of lecithine on fat deposition in the liver of the normal rat». The Journal of Physiology 75 (1): 56–66. May 1932. doi:. PMID 16994301.
- ↑ Institute of Medicine (US) Standing Committee on the scientific evaluation of dietary reference intakes and its panel on folate, other B. vitamins, and choline. National Academies Press (US). 1998. σελίδες xi, 402–413. ISBN 9780309064118.