Natria fosfido
| Natria fosfido | |||
 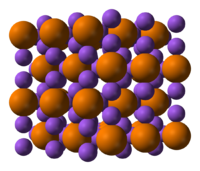
| |||
| Kristala strukturo de la Natria fosfido | |||

| |||
| 3D Kemia strukturo de la Natria fosfido | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemiaj formulaĵoj | Na2P5 Na3P7 Na3P11 NaP7 NaP15 | ||
| CAS-numero-kodo | 12058-85-4 | ||
| ChemSpider kodo | 55463 | ||
| PubChem-kodo | 61547 | ||
| Fizikaj proprecoj | |||
| Aspekto | Ruĝaj kristaloj | ||
| Molmaso |
| ||
| Denseco | 1,74 g/cm3 | ||
| Fandopunkto | 650 °C (1,202 ℉; 923 K) | ||
| Solvebleco |
| ||
| Sekurecaj Indikoj | |||
| Risko | R15 R28 R29 R30 R32 | ||
| Sekureco | S(1/2 S)3/9/14 S30 S36/37 S45 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS etikedigo de kemiaĵoj | |||
| GHS Damaĝo-piktogramo |
| ||
| GHS Signalvorto | Averto | ||
| GHS Deklaroj pri damaĝoj | H225, H315, H319, H335 | ||
| GHS Deklaroj pri antaŭgardoj | P101, P102, P103, P210, P241, P303+361+353, P305+351+338 | ||
(25 °C kaj 100 kPa) | |||
Natria fosfido, fosfido de natrio aŭ Na3P estas neorganika kombinaĵo de natrio kaj fosforo, jona salo de alkala metalo kun fosfida anjono(P3−). Natrio kaj fosforo estigas sennombrajn fosfidojn, tiel kiel Na3P, Na2P5, Na3P7, Na3P11 kaj NaP7, NaP15.
Fosfido de natrio estas bruliva substanco kiam ekspoziciata al hejtado aŭ flamo. Ĝi reakcias kun akvo por estigi NaOH, iu koroda materialo, kaj fosfino, bruliva kaj venena gaso[1]. Fosfino ordinare spontanee ekfajras kun aero. Se ekzistas troo da akvo, la fajro de la fosfino kutime ne ekbrulas la ĉirkaŭantajn materialojn.
Sintezo
[redakti | redakti fonton]- Ĝi sintezeblas ekde reakcio inter metala natrio kaj fosfora kvinklorido sub alta temperaturo:
- Sekve, oni povas izoli la rezultajn produktojn:
- Vakua reakcio inter fosfino kaj metala natrio sub alta temperaturo:
Reakcioj
[redakti | redakti fonton]- Ĝi reakcias kun akvo por estigi natrian hidroksidon:
YouTube
[redakti | redakti fonton]Literaturo
[redakti | redakti fonton]- Cameo Chemicals
- Chemical Book
- Environmental Chemistry
- Hamilton and Hardy's Industrial Toxicology, Raymond D. Harbison, Marie M. Bourgeois, Giffe T. Johnson
- The Pearson Guide To Inorganic Chemistry For The Iit Jee, Singhal
- The Pearson Guide to Objective Chemistry for the AIEEE, Singhal Atul
- The Chemistry of Lithium, Sodium, Potassium, Rubidium, Cesium and Francium ..., William A. Hart,O. F. Beumel,Thomas P. Whaley
| ||||||
Referencoj
[redakti | redakti fonton]- ↑ Glossary for the Worldwide Transportation of Dangerous Goods and Hazardous ..., Malcolm A. Fox
- ↑ Chemistry Vol (1 and 2). Arkivita el la originalo je 2016-03-05. Alirita 2015-08-28 .











