Proteina strukturo

Proteina strukturo estas la nomo de stato de proteino deduktebla el la biokemia fenomenoj aludataj ĉi-sube:
Proteinoj estas ĉenoj de aminoacidoj konstituita per 20 L-α-amminoacidoj diversaj, nomataj ankaŭ reziduoj, kiuj refaldiĝas en tridimesiaj unikaj strukturoj. La formo en kiu la proteino refaldiĝas estas nomata denaska stato, determinita per sia sekvenco de aminoacidoj. Se la reziduoj estas malpli ol 40 la rezulto ofte nomiĝas peptido anstataŭ proteino. Certa nombro de reziduoj estas bezonata por ke efektiviĝu certa biokemia funkcio; kaj la baza limo por certa finkcia dimensio ŝajnas esti ĉirkaŭ 40/50 reziduoj.
La dimensioj de proteino etendiĝas el tiu limo ĝis al diversaj miloj da reziduon en plurdimensiaj kaj strukturitaj proternoj. Ciukaze, la mezura nombro de la lungo de iu proteino entenas ĉirkaŭ 300 reziduojn. Proteinaj agregaĵoj multe pli grandaj povas esti formitaj per multaj proteinaj subunuoj, ekzemple, multaj miloj da molekuloj de aktino kunmuntiĝas en filamento de aktino. Troviĝas krome kompleksaj proteinoj kiel en RNA. en la partikloj ribosomaj kiuj formmas, ĝuste, la ribosomojn.
Biokemiistoj distingas kvar biokemuajn statojn de la proteina strukturo kaj ilin ties difinas:
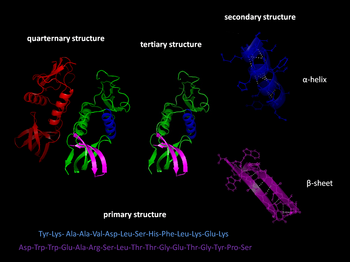
- Primara strukturo: la sekvenco de aminoacidoj.

- Sekundara strukturo: substrukturoj ege modiftlaj – alfa-helico kaj beta-lameno refaldita – aŭ ĉenaj segmentoj kiuj ricevas formon nestabilan. La sekundaraj molekuloj estas plurtipaj eĉ en iu aparta proteina molekulo.
- Terciara strukturo: la globala formo de iu aparta proteina molekulo, aŭ la spaca rilato de la modelo de la sekundara strukturo kun alia modelo.
- Kvarternara strukturo: la formo aŭ la strukturo kiu rezultas el la unuiĝo de diversaj proteinaj molekuloj, kutime difinitaj proteinaj subunuoj en tiu kunteksto, kies funkcioj partoprenas en la globala funkcio de la granda elemento sŭ proteina komplekso.
Aldona al tiuj niveloj de strukturo la proteinoj povas translokiĝi tra diversaj similaj strukturoj dum la realiĝo de sia biologia finkcio. En la kunteksto de tiuj rearanĝoj la transmigroj estas difimitaj konformaciaj ŝanĝiĝoj.
La primaja strukturoj estas zubtenata de peptidaj ligiloj kovalentaj kiuj formiĝas dum la procezo de translokiĝo. La sekundaraj strukturoj, male, estas subtenataj de ligiloj hidrogeno. La terciara strukturo estas subtenata per hidrofobiaj interagoj kaj poste de ligiloj hidrogrno. jonaj interagoj kaj disulfuraj pontoj.