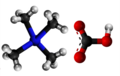
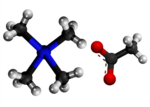
Tetrametilamonia hidroksido
| Tetrametilamonia hidroksido | |||||
| Kemia formulo | |||||
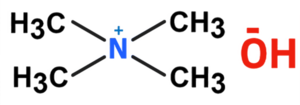 | |||||
Tetrametilamonia hidroksido | |||||
 | |||||
 | |||||
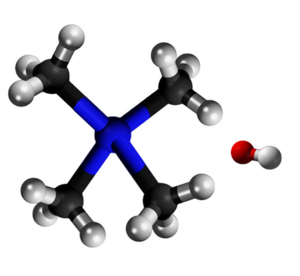
| Kristala strukturo de la tetrametilamonia hidroksido N O CH3 | |||||
 | |||||
| Specimeno de solvaĵo de la tetrametilamonia hidroksido. | |||||
| Alternativa(j) nomo(j) | |||||
| Hidroksido de tetrametilamonio | |||||
| CAS-numero-kodo | 75-59-2 10424-66-5 10424-65-4 104422-11-9 105468-35-7 143549-79-5 195460-1 129653-91-4 129654-61-1 154636-59-6 | ||||
| ChemSpider kodo | 54928 | ||||
| PubChem-kodo | 60966 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | kristalblanka, brulema, toksa solidaĵo | ||||
| Molmaso | 91,154g mol−1 | ||||
| Denseco | 0,866 g/cm−3[1][2] | ||||
| Fandpunkto | 67°C | ||||
| Bolpunkto | 110°C [3] | ||||
| Refrakta indico | 1,3806[4] | ||||
| Solvebleco | Akvo:1100 g/L [5] * Solvebla en metanolo kaj etanolo (750 g/L). | ||||
| Mortiga dozo (LD50) | 125 mg/kg (buŝe) [6] | ||||
| GHS etikedigo de kemiaĵoj | |||||
| GHS Damaĝo Piktogramo |
| ||||
| GHS Signalvorto | Damaĝa substanco | ||||
| GHS Deklaroj pri damaĝoj | H226, H300+310, H314, H331, H370, H372, H412 | ||||
| GHS Deklaroj pri antaŭgardoj | P260, P264, P270, P280, P301+310, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P361, P363, P405, P501 | ||||
(25 °C kaj 100 kPa) | |||||
Tetrametilamonia hidroksido (TMAH) aŭ hidroksido de tetrametilamonio estas organika kombinaĵo, kvaternara salo de nitrogeno, apartenanta al la familio de la hidroksidoj, rezultanta el hidrolizo de la tetrametilamonia klorido. Tetrametilamonia hidroksido estas kristalblanka aŭ flaveca (pro malpureco), brulema, toksa, senodora (tiam kiam pura aŭ fiŝodora - tiam kiam malpura) solidaĵo, solvebla en akvo, metanolo, etanolo kaj estas forta bazo. Tetrametilamonia hidroksido prezentas kvar metilajn grupojn ligitajn al nitrogenatomo kiu siavice ligiĝas jone al hidroksila grupo. Tetrametilamonia hidroksido estas kvaternara amonia komponaĵo, en anhidra stato, ĝi okazas kiel blankaj kristaloj kun forta amoniakodoro. La substanco estas higroskopa kaj formas pentahidraton kun humideco (CAS numero: 10424-65-4). TMAH abosrbas karbonan duoksidon. Pro manko da hidrogenaj ligiloj, tetrametilamonia hidroksido estas pli forta bazo ol trimetilamonia klorido.[7]
Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Preparado de la tetrametilamonia hidroksido per traktado de metila klorido, amoniako kaj akvo:
Reakcio 2
[redakti | redakti fonton]- Preparado de la tetrametilamonia hidroksido per traktado de tetrametilamonia klorido kaj kalia hidroksido':
Reakcio 3
[redakti | redakti fonton]- Preparado de la tetrametilamonia hidroksido per hidrolizo de la tetrametilamonia bikarbonato:
Reakcio 4
[redakti | redakti fonton]- Preparado de la tetrametilamonia hidroksido per hidrolizo de la tetrametilamonia acetato:
Reakcio 5
[redakti | redakti fonton]- Preparado de la tetrametilamonia bikarbonato per traktado de tetrametilamonia hidroksido kaj karbona duoksido :






![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)