1,2-dicloroetano
| 1,2-Dicloroetano | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| 1,2-Dicloroetano | ||
| General | ||
| Otros nombres | freón 150 | |
| Fórmula estructural |
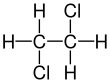 | |
| Fórmula molecular | C2H4Cl2 | |
| Identificadores | ||
| Número CAS | 107-06-2[1] | |
| Número RTECS | KI0525000 | |
| ChEMBL | CHEMBL16370 | |
| UNII | 55163IJI47 | |
| KEGG | C06752 | |
| Propiedades físicas | ||
| Apariencia | Líquido incoloro | |
| Densidad | 1253 kg/m³; 1,253 g/cm³ | |
| Masa molar | 9896 g/mol | |
| Punto de fusión | −35 °C (238 K) | |
| Punto de ebullición | 84 °C (357 K) | |
| Propiedades químicas | ||
| Momento dipolar | 1,8 D | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El compuesto químico 1,2-dicloroetano (DCA) comúnmente conocido por su antiguo nombre de dicloruro de etileno (EDC), es un hidrocarburo clorado, utilizado principalmente para producir el monómero de cloruro de vinilo (VCM, o cloroeteno), el principal precursor para la producción del polímero PVC. Es un líquido incoloro con un olor parecido al cloroformo. El 1,2-dicloroetano también se utiliza generalmente como un compuesto intermedio para otros compuestos químicos orgánicos, como disolvente. Forma azeótropos con muchos otros disolventes, incluso el agua (punto de ebullición 70,5 °C) y otros organoclorados.[2]
Fue un plaguicida ahora ya prohibido en todas sus formulaciones y usos por ser dañino para la salud humana y el medio ambiente.
Historia
[editar]En 1794, un grupo de cuatro amigos neerlandeses, conocido como el Gezelschap der Hollandsche Scheikensleishen (Sociedad de químicos holandeses), compuesto por el médico Jan Rudolph Deerman, el comerciante Adriaan van Paets Troopstwijkity, el químico Anthoni Lauwerenburgest y el botánico Nicolaas Bondtitigutrud fueron los primeros que produjeron el 1,2-dicloroetano a partir del gas olefínico etileno y cloro. En reconocimiento de sus investigaciones y sus publicaciones, y disfrutando en su época de una buena reputación, el 1,2-dicloroetano fue conocido en la historia de la química bajo el nombre de aceite holandés (Dutch oil).
Resumen de la medida de prohibición como plaguicida
[editar]- Prohibida la producción, uso y comercialización de todos los productos de protección de plantas que contengan dicloruro de etileno.
- El producto está designado como un producto químico CFP.
- Está permitido el uso del producto químico para la investigación o propósitos de laboratorio en cantidades menores de 10 kg.
- Efecto previsto de la medida reglamentaria firme en relación con la salud humana: El producto químico no está más registrado para el uso como plaguicida en varios países signatarios del Convenio de Róterdam, como por ejemplo en Canadá.
- Fecha de entrada en vigor de la medida de prohibición: 31/12/1985, en Canadá
Peligros y riesgos conocidos respecto a la salud humana
[editar]El uso del dicloruro de etileno como producto de protección de plantas, en particular para fumigar plantas y terrenos, podría dar lugar a efectos peligrosos para la salud humana y animal así como una excesiva influencia adversa en el medio ambiente. El dicloruro de etileno se absorbe rápidamente en el cuerpo a través de la piel, por inhalación del vapor y por ingestión. Los primeros síntomas de intoxicación aguda son dolor de cabeza, mareo, debilidad, espasmos musculares y vómito, irritación de las membranas mucosas de los ojos y del tramo respiratorio. La exposición puede dar lugar también a cambios en la sangre y en el ritmo cardiaco (insuficiencia cardiovascular) que puede ser letal. Se han registrado también cambios en los riñones e hígado como resultado de la exposición.
La ingestión o inhalación aguda del cloruro de etileno causa daños al corazón, sistema nervioso central (SNC), hígado, riñones y pulmones. La exposición a una inhalación aguda resulta en una ofuscación de la córnea, irritación de ojos, neurotoxicidad, toxicidad renal, toxicidad hepáticos, sufrimiento respiratorio, arritmia cardiaca, náusea y vómito.
La inhalación crónica ocasiona efectos en hígado y riñones. Estudios animales han demostrado reducida habilidad para combatir las infecciones y han reportado efectos en el SNC después de una ingestión crónica de cloruro de etileno.
Estudios de inhalación para ratas reportaron fertilidad reducida, mayor incidencia de lesiones en los testículos e incremento de la mortalidad del embrión. Estudios animales muestran que el cloruro de etileno causa una variedad de tumores a consecuencia de la ingestión, inhalación o exposición dérmica.
El cloruro de etileno es un probable carcinógeno para el hombre.
Peligros y riesgos conocidos respecto al medio ambiente
[editar]Ya que el dicloruro de etileno se libera principalmente con las emisiones de fuentes industriales y dada su alta volatilidad, la atmósfera es el absorbente predominante en medio ambiente para el producto. Es moderadamente persistente en el aire. La fotólisis estratosférica puede producir radicales de cloro, que pueden a su vez reaccionar con ozono. Sin embargo, el potencial de disminución del ozono es bajo (0,001 relativo al CFC-11), y el compuesto no está incluido en el Protocolo de Montreal sobre Sustancias que disminuyen la capa de ozono. Los organismos terrestres tendrán el mayor potencial de exposición al dicloruro de etileno en el aire del ambiente. No obstante, los datos disponibles sobre los efectos del dicloruro de etileno son inadecuados para permitir la caracterización de los riesgos para las especies terrestres. Si bien el dicloruro de etileno puede ser liberado en la superficie de las aguas o al terreno a través de procesos industriales y de eliminación, y aunque la hidrólisis y la degradación microbiana sean lentas, la sustancia no es probable que persista en estos medios a causa de su volatilidad. Una serie de pruebas de toxicidad en especies acuáticas han indicado que los nivelas de efecto están generalmente sobre 10 mg/litro. Como las concentraciones en las aguas superficiales son generalmente de varios órdenes de magnitudes menores que las que han demostrado causar efectos, es probable que el dicloruro de etileno represente un riesgo insignificante para los organismos acuáticos.
Referencias
[editar]- ↑ [http://www.chemicalbook.com/CASEN_107-06-2.htm 107-06-2 Número CAS]
- ↑ Manfred Rossberg, Wilhelm Lendle, Gerhard Pfleiderer, Adolf Tögel, Eberhard-Ludwig Dreher, Ernst Langer, Heinz Rassaerts, Peter Kleinschmidt, Heinz Strack, Richard Cook, Uwe Beck, Karl-August Lipper, Theodore R. Torkelson, Eckhard Löser, Klaus K. Beutel, Trevor Mann "Chlorinated Hydrocarbons" in Ullmann's Encyclopedia of Industrial Chemistry 2006, Wiley-VCH, Weinheim. http://dx.doi.org/10.1002/14356007.a06_233.pub2
- Secretaría para el Convenio de Róterdam sobre el procedimiento de consentimiento fundamentado previo aplicable a ciertos plaguicidas y productos químicos peligrosos objeto de comercio internacional - Apéndice IV - Partes CIRCULAR CFP XXII - diciembre de 2005.