Acondroplasia
| Acondroplasia | ||
|---|---|---|
 | ||
| Especialidad | genética médica | |
| Síntomas | Brazos y piernas cortos, cabeza agrandada, frente prominente | |
| Complicaciones | Infecciones de oído , hiperlordosis , dolor de espalda , estenosis espinal , hidrocefalia. | |
| Causas | Genético ( mutación autosómica dominante en el gen FGFR3 | |
La acondroplasia es una displasia ósea ocasionada por una alteración genética y la causa del 90 % de casos de enanismo.[1] Su principal rasgo físico es el de las extremidades cortas, mientras que el tronco es de tamaño promedio. El 75 % de los casos son consecuencia de una mutación genética nueva, y el 25 % restante son heredados, necesitándose sólo un gen mutado de uno de los padres, ya que es un gen autosómico dominante. El trastorno consiste en una mutación que genera alteraciones en el receptor del factor de crecimiento de los fibroblastos, lo que a su vez genera anomalías en la formación de cartílago de crecimiento y, por lo tanto, en el crecimiento de los huesos.
El cuadro se presenta en uno de cada 25 000 nacidos vivos.[2] Es el tipo más frecuente de enanismo y se caracteriza por talla baja al nacer y una serie de alteraciones en la forma del cuerpo (dismorfias), entre las cuales destacan: macrocefalia, hipoplasia de la región maxilar, acortamiento de los huesos largos y dedos, y radiológicamente, platispondilia, disminución de la distancia interpedicular de la columna lumbar, deformidad de las regiones metafiso-epifisiarias, huesos ilíacos cuadrados y marcadamente disminuidos de altura y un Foramen magno estrecho, entre otras. El diagnóstico fenotípico es evidente en cualquier etapa de la vida, incluso en ocasiones durante el período prenatal[3]
Las personas con esta mutación genética tienen un cincuenta por ciento de probabilidades de tener un hijo propio con este mismo trastorno. Si dos personas con acondroplasia tienen un hijo, existe un 50 % de probabilidades de que este herede la anomalía, un 25 % de probabilidades de tener un bebé de altura promedio y un 25 % de probabilidades de que el bebé tenga lo que se conoce como «doble dominancia» de la acondroplasia. Esta última es, en todos los casos, fatal en la infancia. Los bebés que nacen con doble dominancia presentan costillas muy pequeñas, así como anomalías cerebrales graves.[4]
Las estatura esperada para las personas con acondroplasia es de 131 centímetros (51,5 pulgadas) para los hombres y de 123 cm (48,4 pulgadas) para las mujeres; sin embargo, la estatura puede ser tan corta como 62,8 cm (24,7 pulgadas). Una característica distintiva de este síndrome es el gibbus toracolumbar en la infancia.
Etiología genética
[editar]
La causa de este trastorno es una mutación en el gen que codifica para el receptor 3 del factor de crecimiento de fibroblastos 3 (FGF3), localizado en el cromosoma 4.[5] Existen dos mutaciones posibles que afectan a este gen: G1138A y G1138C. Ambas son puntuales,[6] donde dos pares de bases complementarias del ADN se intercambian:
- Mutación G1138A: en el nucleótido número 1138, la guanina es sustituida por adenina. En el 98 % de los casos de acondroplasia, se sufre esta mutación.[7]
- Mutación G1138C: tiene lugar el cambio de guaninas por citosina, también en el nucleótido 1138. La frecuencia de esta alteración es mucho menor, apenas en el 2 % de los casos.[7]
En ambas situaciones, la repercusión en la cadena aminoacídica de la proteína FGFR3 es la misma: el cambio del aminoácido glicina por una arginina.
Dicha mutación puede darse de dos formas distintas: por herencia autosómica dominante, cuando hay antecedentes familiares de enfermedad (alrededor del 10 % de los casos) y por una mutación de novo, con padres sanos (es la causa más frecuente, hasta en el 90 % de los pacientes).[8]
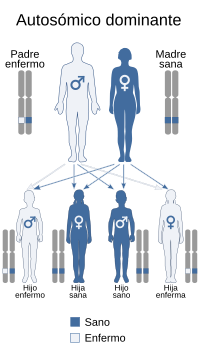
Herencia genética
[editar]La herencia de este trastorno es autosómica dominante lo que significa que, para padecerlo, basta con que se herede el gen mutado de, al menos, uno de los progenitores. Las posibilidades genotípicas y su correspondencias fenotípicas, son las siguientes:
- Homocigoto (G1138A/G1138A):[9] es la forma más grave del trastorno y suele ser letal durante el período neonatal. Para que tenga lugar, es necesario que ambos progenitores tengan acondroplasia (heterocigotos, pues los homocigotos no sobreviven). Ocurre en el 25 % de los hijos cuando ambos progenitores son acondroplásicos.[8][10]
- Heterocigoto (G1138A/alelo normal):[9] a este genotipo se puede llegar desde tres supuestos posibles.
- Si ambos padres tienen acondroplasia, la posibilidad de que el hijo sea heterocigoto para el trastorno es de un 50 %.
- Si únicamente uno de los padres es acondroplásico, también hay un 50 % de posibilidades de heredarlo.
- En la mayor parte de los casos heterocigóticos, el trastorno se debe a una mutación nueva, por lo que los dos padres son de estatura normal.[8][6]
Mutación de novo
[editar]En torno al 80 % de los afectados de acondroplasia no tienen antecedentes familiares del trastorno. El motivo son mutaciones espontáneas o de novo (G1138A o G1138C) que afectan a la línea germinal paterna. Son, por tanto, mutaciones que ocurren en los gametos del padre (espermatozoides) durante la espermatogénesis. Estas alteraciones se dan, como su nombre indica, de forma espontánea, lo que implica un desconocimiento de su causa; sin embargo, numerosos estudios parecen constatar una relación de la mutación de novo con la edad del padre en el momento de la fecundación, de tal manera que tener más de 35-40 años parece suponer un factor de riesgo para tener un hijo acondroplásico. La frecuencia de aparición de la acondroplasia se distribuye de igual manera entre individuos de ambos sexos y de cualquier raza.[11]
Epidemiología
[editar]Debido a que la acondroplasia es una enfermedad que tiene manifestaciones similares a otras 19 enfermedades congénitas (osteogénesis imperfecta, displasia epifisaria múltiple tardía, acondrogénesis, osteopetrosis, displasia tanatofórica, etc.), las estimaciones de su prevalencia son difíciles puesto que los criterios diagnósticos son subjetivos y cambian con el tiempo. Un ejemplo de lo anterior es que estudio detallado y de larga duración en los Países Bajos mostró que la prevalencia determinada al nacer de solo 1,3 por cada 100 000 nacidos vivos, mientras que otro estudio realizado al mismo tiempo encontró una tasa de 1 por cada 10 000.[12] El estudio europeo más amplio realizado sobre la enfermedad encontraba una prevalencia de 3,72 casos por 100 000 nacimientos.[1]
Causas
[editar]Normalmente el factor de crecimiento de fibroblastos (FGF) tiene efecto regulador en el crecimiento de los huesos. En la acondroplasia el receptor de este factor (FGFR3) se encuentra mutado, por lo que este se encuentra constitutivamente activo lo cual lleva al acortamiento de los huesos.
Las personas con acondroplasia tienen una copia normal del gen del factor FGFR3, pero también tienen una copia mutada. Dos copias del gen mutado es fatal desde antes del nacimiento. En cuanto a la herencia genética, una persona con acondroplasia tiene el 50 % de probabilidades de heredar esta enfermedad a sus hijos, lo cual significa que hay un 50 % de probabilidades de que cada niño herede esta enfermedad. Por otro lado, si ambos padres tienen acondroplasia, sus hijos tienen un 25 % de probabilidades de morir poco tiempo después de su nacimiento, y un 50 % de probabilidades de que tenga acondroplasia y un 25 % de que el niño presente el fenotipo.
No todas las personas que nacen con acondroplasia tienen padres con esta misma condición, ya que esto puede ser resultado de una nueva mutación.[13] Esta condición no se adquiere necesariamente por herencia genética ya que existen nuevas mutaciones de los genes que pueden llevar a la acondroplasia.Existen algunos estudios que suponen que la edad avanzada de los padres puede ser un factor de riesgo[14]
Estudios actuales han demostrado que las nuevas mutaciones de los genes para acondroplasia son heredados exclusivamente del padre y que ocurre durante las espermatogénesis;[11] pues durante la ovogénesis existe algún tipo de mecanismo regulador que impide la mutación de los genes, sin embargo las mujeres siguen siendo capaces de presentar el fenotipo y genotipo, y (por lo tanto) de transmitir el alelo mutante.
Más del 99 % de (la) acondroplasia es causada por dos mutaciones diferentes del factor FGFR3. En aproximadamente el 98 % de los casos, un punto mutado G a uno A dentro del nucleótido 1138 del gen factor FGFR3 causa una substitución de la glicina por la arginina (Bellus et al. 1995, Shiang et al. 1994, Rousseau et al. 1996). El otro 1 % de los casos (restantes) son causados por un punto mutado G a uno C dentro del nucleótido 1138. El gen mutantefue descubierto por John Wasmuth y sus colegas en 1994.
Existen dos síndromes que tienen una base genética similar a la acondroplasia: hipocrondroplasia y la displasia tanatofórica.
Signos y síntomas clínicos
[editar]
Las personas con acondroplasia muestran una presencia física característica como consecuencia de la interrupción del desarrollo del cartílago en las epífisis de los huesos, haciéndose más notable en los huesos largos húmero y fémur, que son los que presentan un crecimiento más rápido. De esta forma presentan una baja estatura, que no suele sobrepasar los 144 cm (centímetros) en la edad adulta,[7] con acortamiento de las extremidades y agrandamiento del cráneo, mientras que el tronco conserva su tamaño normal. A continuación se muestran los hallazgos anatomoclínicos más importantes de esta enfermedad:
- Extremidades superiores: aunque son más cortas que en un individuo normal, los antebrazos son más largos que los brazos y son incapaces de realizar una extensión completa del codo.
- Extremidades inferiores: al igual que ocurre en los brazos, los miembros inferiores también son más cortos con mayor evidencia en el fémur que en la tibia. El eje de las rodillas toma una postura anómala y origina el genu varo, una mayor separación entre ambas rótulas que origina unas extremidades inferiores arqueadas.[15]
- Signo del tridente: hace referencia a la separación existente entre el tercer (corazón o medio) y cuarto (anular) dedo de la mano.
- Alteraciones en la columna vertebral: durante la infancia pueden presentar una cifosis dorsal por la falta de tono muscular. En ocasiones, se combina con una hiperlordosis lumbar que intenta compensar la desviación.
El diagnóstico consiste en una ecografía fetal por discordancia progresiva entre la longitud del fémur y el diámetro biparietal por edad. Una prueba de ADN puede ser realizada antes del nacimiento para detectar la homocigosidad de la mutación, una condición que como ya se mencionó resulta letal.
Hallazgos radiológicos
[editar]Un estudio radiológico del esqueleto es útil para confirmar el diagnóstico de acondroplasia. En este estudio se puede observar un cráneo grande, con un estrecho agujero occipital y una base relativamente pequeña; cuerpos vertebrales cortos y aplanados con un espacio intervertebral relativamente grande; alas iliacas pequeñas y cuadradas[16] con una muesca ciática estrecha y un techo acetabular horizontal; huesos tubulares cortos y gruesos con ventosas metafisarias y placas de crecimiento irregulares; crecimiento excesivo del peroné; manos anchas con metacarpos y falanges cortas y costillas cortas con forma de copa en los extremos anteriores.
Si las características radiológicas no son clásicas, la búsqueda de un diagnóstico diferencial debe ser considerado.
Tratamiento
[editar]A pesar de que se conoce la mutación del gen en el receptor del factor de crecimiento, actualmente no existe un tratamiento conocido para tratar la acondroplasia y la Cretinismo.
La hormona de crecimiento es usada por personas que no tienen acondroplasia para ayudarlas con su crecimiento, sin embargo esta no es efectiva en las personas que sí la padecen. A pesar de ello si lo desean pueden someterse a una cirugía de alargamiento de miembros, que a pesar de ser un tema controvertido ha sido efectiva en algunos casos.[17] Generalmente, los mejores resultados aparecen dentro del primer y segundo año de la terapia con hormona del crecimiento.[18]
Después del segundo año de terapia el efecto benéfico del crecimiento del hueso comienza a disminuir.[19] Es por esto que la terapia con hormonas del crecimiento no tiene efectos satisfactorios a largo plazo.[18]
La terapia génica se encuentra aún en desarrollo. Una compañía de Estados Unidos, BioMarin Pharmaceutical Inc., anunció recientemente el inicio de un estudio de fase I en voluntarios sanos para BMN-111, un análogo del péptido natriurético del tipo C, para el tratamiento de la acondroplasia. Las últimas investigaciones son reguladas y controladas por la organización no lucrativa Growing Stronger.
En otras especies
[editar]Debido a un enanismo desproporcionado en algunas razas de perros, estos han sido clasificados como acondroplásicos. Como tal, es el caso de las razas Dachshund, Basset hound y Bulldog, esto por mencionar solamente algunas de ellas.[20][21]
Datos de la Asociación de genómica, en estudios en perros con extremidades cortas, han mostrado su estrecha relación con una codificación retro genética del factor de crecimiento 4 (FGF4).[22] Por lo tanto, parece poco probable que los perros y humanos desarrollen acondroplasia por las mismas razones. Sin embargo, estudios histológicos en algunos perros acondroplásicos han mostrado alteraciones en los patrones de células en los cartílagos, lo cual es muy similar a lo observado en los humanos que presentan la enfermedad.[23]
Un tipo similar de acondroplasia se encontró en una camada de lechones daneses que tenía un fenotipo normal aparente. El enanismo fue dominante en la descendencia de la madre, y aunque los lechones nacieron fenotípicamente normales, con el tiempo se fue haciendo cada vez más evidente el padecimiento.[24]
Referencias
[editar]- ↑ a b McDonald, Edward J.; De Jesus, Orlando (2021). Achondroplasia. StatPearls Publishing. Consultado el 11 de octubre de 2021.
- ↑ Wynn J, King TM, Gambello MJ, Waller DK, Hecht JT (2007). Mortality in achondroplasia study: A 42-year follow-up (en inglés) 143 (21). Am. J. Med. Genet. A. pp. 2502-2511. PMID 17879967. doi:10.1002/ajmg.a.31919.
- ↑ Wynne-Davies, R.; Walsh, W. K.; Gormley, J. (1 de noviembre de 1981). «Achondroplasia and hypochondroplasia. Clinical variation and spinal stenosis». Bone & Joint Journal (en inglés). 63-B (4): 508-515. ISSN 2049-4394. PMID 7298674. Archivado desde el original el 25 de septiembre de 2017. Consultado el 24 de septiembre de 2017.
- ↑ «Qué aspecto tienen?». acondroplasiabg.blogspot.cl. Consultado el 24 de septiembre de 2017.
- ↑ «FGFR3 fibroblast growth factor receptor 3 [Homo sapiens (human)] - Gene - NCBI». www.ncbi.nlm.nih.gov. Consultado el 11 de octubre de 2021.
- ↑ a b Dr. Vázquez-Contreras. «Tipos de mutaciones puntuales». Archivado desde el original el 14 de septiembre de 2008. Consultado el 6 de agosto de 2008.
- ↑ a b c Santana Ortega AT.; Castro Hernández JJ.; Fuentes Luis A. «Guía sobre la acondroplasia dirigida a la familia y profesionales de la salud». Archivado desde el original el 20 de noviembre de 2008. Consultado el 6 de agosto de 2008.
- ↑ a b c «¿Qué es la acondroplasia?». Archivado desde el original el 5 de julio de 2008. «Fundación Magar de la Acondroplasia».
- ↑ a b Ídem con la mutación G1138C.
- ↑ En los cálculos de probabilidad genéticos, no se tiene en cuenta la homocigosis para el trastorno por la mortalidad que conlleva dicho genotipo.
- ↑ a b
- ↑ OMIM 100800
- ↑ Richette P, Bardin T, Stheneur C (2007). Achondroplasia: From genotype to phenotype (en inglés) 75 (2). Joint Bone Spine. pp. 125-130. PMID 17950653. doi:10.1016/j.jbspin.2007.06.007.
- ↑ Dakouane Giudicelli M, Serazin V, Le Sciellour CR, Albert M, Selva J, Giudicelli Y (2007). Increased achondroplasia mutation frequency with advanced age and evidence for G1138A mosaicism in human testis biopsies (en inglés) 89 (6). Fertil Steril. pp. 1651-6. PMID 17706214. doi:10.1016/j.fertnstert.2007.04.037.
- ↑ «Desviaciones axiales y rotacionales de miembros inferiores en niños». Archivado desde el original el 5 de abril de 2008. «El genus varo puede ser fisiológico o patológico.»
- ↑ «Achondroplasia Pelvis». Archivado desde el original el 22 de octubre de 2007. Consultado el 28 de noviembre de 2007.
- ↑ Kitoh H, Kitakoji T, Tsuchiya H, Katoh M, Ishiguro N (2007). Distraction osteogenesis of the lower extremity in patients that have achondroplasia/hypochondroplasia treated with transplantation of culture-expanded bone marrow cells and platelet-rich plasma (en inglés) 27 (6). J Pediatr Orthop. pp. 629-34. PMID 17717461. doi:10.1097/BPO.0b013e318093f523.
- ↑ a b Vajo, Z; Francomano, CA; Wilkin, DJ (2000). The molecular and genetic basis of fibroblast growth factor receptor 3 disorders: the achondroplasia family of skeletal dysplasias, Muenke craniosynostosis, and Crouzon syndrome with acanthosis nigricans. (en inglés) 21 (1). Endocrine Reviews. pp. 23-39. PMID 10696568. doi:10.1210/er.21.1.23.
- ↑ Aviezer, D; Golembo, M; Yayon, A (2003). Fibroblast growth factor receptor-3 as a therapeutic target for Achondroplasia--genetic short limbed dwarfism. (en inglés) 4 (5). Current drug targets. pp. 353-365. PMID 12816345. doi:10.2174/1389450033490993.
- ↑ Jones, T.C.; Hunt, R.D.; (1979). «The musculoskeletal system». En Jones, T.C.; Hunt, R.D.; Smith, H.A., ed. Veterinary Pathology (5th edición). Philadelphia: Lea & Febiger. pp. 1175-1176. ISBN 0812107896.
- ↑ Willis M.B. (1989). «Inheritance of specific skeletal and structural defects». En Willis M.B., ed. Genetics of the Dog (en inglés). Great Britain: Howell Book House. pp. 119-120. ISBN 087605551X.
- ↑ Parker HG, VonHoldt BM, Quignon P, et al. (agosto de 2009). An expressed fgf4 retrogene is associated with breed-defining chondrodysplasia in domestic dogs (en inglés) 325 (5943). Science. pp. 995-998. PMC 2748762. PMID 19608863. doi:10.1126/science.1173275.
- ↑ Braund KG, Ghosh P, Taylor TK, Larsen LH (septiembre de 1975). Morphological studies of the canine intervertebral disc. The assignment of the beagle to the achondroplastic classification (en inglés) 19 (2). Res. Vet. Sci. pp. 167-172. PMID 1166121.
- ↑ Nielsen VH, Bendixen C, Arnbjerg J, et al. (diciembre de 2000). Abnormal growth plate function in pigs carrying a dominant mutation in type X collagen (en inglés) 11 (12). Mamm. Genome. pp. 1087-1092. PMID 11130976. doi:10.1007/s003350010212. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).