Agonista nicotínico
Un agonista nicotínico es cualquier sustancia que imite la acción de la acetilcolina (ACh) en los receptores de acetilcolina (nAChRs). El nAChR, acrónimo de nicotinic acetylcholine receptor en inglés, es nombrado así por su afinidad a la nicotina. Entre los agonistas nicotínicos se cuentan, además de la nicotina misma, la acetilcolina — agonista endógeno de los receptores nicotínicos de acetilcolina—, la colina, la epibatidina, la lobelina, la vareniclina y la cisteína. Debido al papel de los receptores nAChR en la trasmisión del señales en el sistema nervioso los agonistas nicotínicos tienen usos como drogas o fármacos.
Historia
[editar]
La nicotina es bien conocida desde hace siglos por su efecto intoxicante. El químico alemán Posselt Reiman fue el primero en aislarla a partir de la planta del tabaco, en 1828.[1] A mediados de los 1980, se descubrieron los efectos positivos en la memoria de los animales. Esas investigaciones dieron paso a una nueva era de los estudios del receptor nicotínico de acetilcolina (nAChR) y su estimulación. Cabe mencionar que, hasta ese entonces, el foco de investigación había estado centrado únicamente en la adicción a la nicotina.[2][3]
El desarrollo de los agonistas nAChR como agentes teurapéuticos empezó a inicios de los 1990. El ABT-418, designado así por Abbott Laboratories, fue uno de los primeros agonistas investigados. En experimentos con monos macacos maduros de diferentes especies y sexo se observó un incremento del tiempo en que permanece activa la memoria a corto plazo. El ABT-418 también se ha examinado con resultados positivos como un posible tratamiento para la enfermedad de Alzheimer, la enfermedad de Parkinson y el trastorno por déficit de atención con hiperactividad.[3]
Uno de los primeros agonistas nicotínicos catalogados como drogas fue la galantamina, un alcaloide vegetal que actúa como un inhibidor leve de la colinesterasa, así como un sensibilizador alostérico para los nAChR.[4]
Receptores nicotínicos de acetilcolina y su sistema de señalización
[editar]
Sistema de señalización
[editar]Las señales colinérgicas se transmiten todo el sistema nervioso mediante el neurotransmisor acetilcolina (ACh), sintetizado y secretado por las neuronas.[5][6] Los principales receptores de la acetilcolina son los receptores nicotínicos y muscarínicos. La estimulación colinérgica influye en diversas actividades fisiológicas, incluyendo el sueño, la ansiedad y el procesamiento del dolor y de las funciones cognitivas.[7]
Receptores nicotínicos de acetilcolina
[editar]Los receptores nicotínicos de acetilcolina (nAChRs) son colinérgicos y se encuentran en el sistema nervioso central, en el sistema nervioso periférico y en los músculos esqueléticos. Estos receptores son ionotrópicos, es decir, están asociados a un canal iónico. Cuando la acetilcolina u otros agonistas nicotínicos se unen a los receptores, el canal iónico se abre y permite la afluencia de cationes como el potasio, el calcio y el sodio. Los nAChRs están compuestos por diferentes subunidades que determinan la estructura cuaternaria del receptor, conocidas como las subunidades α (α1-α10), subunidades β (β1-β4), y subunidades γ, δ y ε. Los nAChRs pueden ser heteroméricos u homoméricos.
Los receptores heteroméricos se hallan en el sistema nervioso central y están compuestos por dos subunidades α y tres subunidades β. Estos receptores contienen dos sitios de enlace y tienen diferentes afinidades por sustancias químicas, dependiendo de la composición de las subunidades. Los sitios de enlace trabajan conjuntamente y deben estar ambos ocupados con un agonista nicotínico para que pueda tener lugar la activación del canal.[8] Los nAChRs compuestos por las subunidades α2-α6 y β2-β4 tienen mayor afinidad por la acetilcolina. Los receptores homoméricos están formados por cinco subunidades idénticas y tienen cinco sitios de enlace situados en las interfaces entre cada par de subunidades adyacentes. A fecha del año 2000, se habían identificado dos receptores homoméricos en los seres humanos, los receptores α7 y α8.[7][9][10][11]
Mecanismo de acción
[editar]
Los agonistas nicotínicos se unen a los receptores de acetilcolina debido a la atracción generada por la diferencia de carga entre ellos y la superficie de los receptores en el sitio de enlace, una oquedad existente entre una subunidad α y la subunidad adyacente del receptor. Una vez que la acetilcolina o agonista se ha alojado en el sitio de enlace se producen movimientos en la subunidad α del receptor en que fortalecen los enlaces químicos entre la molécula y el receptor.[12] La configuración del receptor y el tipo de subunidades que lo componen influyen en la afinidad del receptor por diferentes tipos de agonistas y antagonistas y en su función biológica.
Receptor α4β2
[editar]Los receptores a4β2 constan de dos subunidades α4 y tres subunidades ß2, con dos sitios de enlace para la acetilcolina y otros agonistas. Representan aproximadamente el 90 % de los receptores nicotínicos en el cerebro humano. La exposición crónica a la nicotina u otros agonistas lleva a un aumento en la densidad de receptores α4β2, a diferencia de lo que suele ocurrir con otros receptores. El receptor α4β2 ha sido ampliamente estudiado en el contexto de la enfermedad de Alzheimer, e investigaciones sobre la dependencia de la nicotina; desde 2009, existen varios fármacos en el mercado que actúan sobre este receptor.[13][14]
Receptor α7
[editar]Los receptores homoméricos α7 están compuestos de cinco subunidades α7 y tienen cinco sitios de enlace. Las anomalías en la expresión de los receptores α7 pueden influir en la progresión de dolencias como la enfermedad de Alzheimer y la esquizofrenia. Se piensa que el α7 no tiene tanta afinidad por la nicotina como los receptores heteromérico, pero se enlaza con mayor preferencia a la alfa-Bungarotoxina, un antagonista nicotínico presente en el veneno de algunas serpientes. Los receptores α7 son considerados un blanco útil para fármacos para el tratamiento de la enfermedad de Alzheimer y la esquizofrenia.[8][15]
Receptor muscular
[editar]Se han descubierto dos receptores nicotínicos en la unión neuromuscular en los músculos esqueléticos. Uno de ellos se encuentra principalmente en individuos adultos y contiene dos subunidades α1 y β1, una subunidad ε y una subunidad δ. El otro tipo de receptor neuromuscular se ha encontrado en los fetos y presenta una subunidad γ en lugar de la subunidad ε. Estos nAChRs toman parte en la despolarización de la terminal muscular mediante el aumento de la permeabilidad a los cationes que causan la contracción muscular.[16] Tienen dos sitios de enlace, uno en la interfaz entre las subunidades α1 y δ y otro entre las subunidades α1 y γ o ε. El gas nervioso y algunos insecticidas actúan como antagonistas de los receptores nicotínicos neuromusculares.[11]
Farmacología
[editar]Los fármacos que actúan sobre los receptores de acetilcolina pueden ser agonistas, agonistas parciales o antagonistas. Los agonistas pueden actuar como agentes despolarizantes, disminuyendo el potencial de membrana en las neuronas durante un tiempo de segundos o minutos, dependiendo de la concentración y el tipo de receptor. La exposición crónica al agonista puede conducir a una desactivación funcional duradera debido a una desensibilización rápida y persistente. Los agonistas parciales parecen estimular la liberación de dopamina en porciones más pequeñas que los agonistas como la nicotina, razón por la que se los ha estudiado como ayuda para dejar de fumar.[17]
La falta de especificidad de algunos de los agonistas nicotínicos es bien conocida, y supone un problema potencial cuando se utilizan para tratar enfermedades que requieren tratamiento centrado en un subtipo específico de nAChR. Entre estos agonistas no específicos se encuentran, por ejemplo, la aceticolina, la nicotina y la epibatidina, todos capaces de unirse a más de un subtipo de receptor.[18]
Farmacóforo
[editar]
El estudio del farmacóforo agonista nicotínico comenzó en 1970, cuando se propuso que la unión de los agonistas a los receptores se efectuaba mediante un enlace entre un átomo de nitrógeno cargado positivamente y un oxígeno carbonilo en la acetilcolina o un nitrógeno en la (S)-nicotina. Desde entonces, se ha demostrado que la presencia de un centro catiónico con un átomo electronegativo y un aceptor de un enlace de hidrógeno son características determinantes.[19] La estereoquímica también es un factor de importancia en el farmacóforo, como se comprueba en el caso de la (S)-nicotina, entre 10 y 100 veces más potente que su isómero (R)-nicotina. El anillo azabicíclico de la epibatidina es otro ejemplo de una interacción estereoquímica favorable. Se ha sugerido que la distancia internitrogénica N+-N está relacionada con la afinidad agonista pero es un factor sujeto a debate. Una densidad electrónica baja en la proximidad del nitrógeno cargado positivamente y una densidad más alta cerca del anillo de piridina —en los compuestos que lo contengan— se considera un factor favorable.[20]
Relación estructura-actividad
[editar]Agonistas de los nAChR musculares
[editar]Se han examinado diversos modelos para determinar las moléculas, grupos funcionales y conformaciones estereoquímicas con mayor afinidad hacia los nAChR. Usando un receptor muscular del subtipo (α1)2β1δγ se obtuvieron los siguientes resultados:
- anatoxina > epibatidinea > acetilcolina > DMPP >> cisteína > pirantel > nicotina > cicutina > tubocurarina > lobelina
Es decir, la anatoxina presentó la mayor actividad y la tubocurarina, la más baja; la acetilcolina indujo una mayor duración de la apertura del receptor, a pesar de no ser tan potente como la anatoxina. Los resultados sugieren que los derivados de la anatoxina serían útiles para comprender la relación entre la estructura y la actividad para los receptores musculares.[21]
Los ésteres biscolina, entre los que se encuentra la succinilcolina, un relajante muscular de acción corta usado en anestesiología, son una clase de compuestos que pueden actuar como un agonista competitivo en nAChRs musculares, por lo que se usan para estudiar la influencia de la estructura en la función. Con un modelo de receptor (α1)2β1δγ de la raya torpedo, se comprobó que la potencia como agonistas de los ésteres biscolina aumenta con la longitud de la cadena. La eficacia, por otro lado, parece ser independiente de la longitud.[22]
Agonistas de los nAChR α4β2
[editar]
La combinación de elementos estructurales de la acetilcolina y la nicotina, así como la reducción de la flexibilidad conformacional mediante el uso de un anillo de ciclopropano, ha llevado al descubrimiento de ligandos potentes y selectivos de nAChR del tipo α4β2. La potencia y selectividad están determinadas por la modulación de tres elementos estructurales, el enlazador, la sustitución en el grupo amino y el anillo de piridina. Los factores que dificultan la unión son el impedimento estérico en el grupo amino y los enlazadores con largas cadenas insaturadas o saturadas. Los enlazadores formados por grupos éter de cadena corta son más propensos a la unión, así como una o dos sustituciones en el anillo de piridina con halógenos u otros grupos. También se ha observado un aumento de la afinidad de unión con la sustitución en el grupo amino de tres diferentes amidas; la metilamida exhibe el más alto grado de unión, lo que se explica por una orientación estérica más favorable o la interacción hidrofóbica con el grupo metilo. La estereoquímica del nitrógeno y el anillo de la piridina y sus efectos estereoelectrónicos tienen un sutil efecto beneficioso en la unión a los receptores α4β2. El ligando de potencia más alta hallado es un éter de piridilo, con sustituciones de bromo en la piridina y amida metilada en el grupo amino.[23]
Agonistas de los nAChR α7
[editar]

La búsqueda de agonistas potentes de los receptores de tipo α7 ha resultado en una serie de compuestos con un alto potencial como fármacos. Como ejemplo se puede citar SEN12333/WAY-317538, un compuesto con un perfil farmacocinético deseable y más afín a los nAChR α7 que a los α1, α3 y α4β2.[15]
El farmacóforo óptimo del agonista de los nAChR α7 está compuesto de tres partes. Hay una porción básica conectada a una cadena de carbono unida a una porción aromática por un puente de amida. El puente de amida se puede invertir sin afectar la potencia del agonista. Las porciones aromáticas con un grupo biarilo muestran más potencia que las que constan de un grupo monoarilo, y una sustitución en la posición 2 del grupo arilo aumenta aún más la potencia. La potencia es mayor para los agonistas con donor o aceptor de H+ en el último arilo del grupo biarilo. Un alto número de aceptores de enlace de hidrógeno podría disminuir la permeabilidad a través de la barrera hematoencefálica, debido a la superficie polar de los agonistas específicos de los nAChR α7.[15]
Existen varios grupos amino cíclicos que pueden actuar como la porción básica sin grandes diferencias en la potencia; entre ellos se cuentan la piperazina, la piperidina y el morfolina. También puede desempeñar este rol una amina terciaria acíclica, pero los grupos de mayor volumen conducen a una pérdida de efectividad.[15]
Muchos derivados de quinuclidina, como la amida de quinuclidina, son agonistas de los receptores α7. Entre los factores que favorecen la potencia y la afinidad de estos agonistas se pueden mencionar una sustitución «para» en el anillo de quinuclidina y una la configuración estereoquímica 3-(R). Asimismo, se da una mayor actividad cuando un anillo de 5 miembros se fusiona a un residuo aromático, especialmente cuando el anillo fusionado es capaz de suministrar electrones deslocalizados al carbonilo de la amida. La actividad disminuye cuando el anillo condensado contiene un átomo con la capacidad de formar un enlace de hidrógeno. Se presume que la rigidez de la quinuclidina y la orientación ortogonal del puente de nitrógeno en relación con el grupo carbonilo de la amida son importantes para la unión óptima con el receptor. Aunque algunos de los derivados de la amida de quinuclidina más potentes son poco estables in vitro, la adición de un grupo metilo en la posición 2 del anillo de quinuclidina aumenta la estabilidad considerablemente.[24]
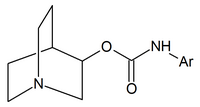
|

|
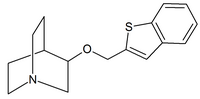
|
| Carbamatos de quinuclidina | Amidas de quinuclidina | Éteres de quinuclidina |
Uso en la medicina
[editar]El interés por los agonistas de receptores nicotínicos de acetilcolina comenzó a principios de la década de 1990 tras el descubrimiento de los efectos positivos de la nicotina en la memoria animal,[2][3] y ha aumentado desde entonces por su potencial como fármacos para tratar varios trastornos del sistema nervioso central, tales como la enfermedad de Alzheimer, la esquizofrenia, el trastorno por déficit de atención con hiperactividad (TDAH) y la adicción a la nicotina.[25][26] La tabla siguiente lista medicamentos en el mercado que actúan en los nAChRs.
| Ingrediente Activo | Producto | Nombre químico | Fármaco | Propiedades farmacodinámicas | Uso terapéutico | Estructura |
|---|---|---|---|---|---|---|
| Vareniclina | Champix, Chantix | 7,8,9,10-tetrahydro-6,10-methano-6H-pyrazino[2,3-h][3]benzazepine[27] | Comprimidos recubiertos | Agonista parcial de los receptores nicotínicos de acetilcolina del subtipo α4β2[28] | Tratamiento de dependencia del tabaco.[28] | 
|
| Galantamina | Reminyl, Nivalin, Razadyne and Razadyn ER | 4a,5,9,10,11,12-hexahydro-3-methoxy-11-methyl-6H-benzofuro[3a,3,2-ef][2]-benzazepin-6-ol[29] | Cápsula de liberación continua, comprimido recubierto, solución oral | Inhibidor de la colinesterasa y agonista no competitivo del receptor nicotínico de acetilcolina[3] | Tratamiento de la enfermedad de Alzheimer[30] | 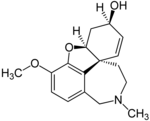
|
| Nicotina | Nicorette, Nicotinell, Niquitin, Boots NicAssist, Commit, Habitrol, Nicoderm CQ, Nicotrol, Thrive | 3-[(2S)-1-methylpyrrolidine-2-yl]pyridine | Parche transdérmico, goma de mascar, inhalador, aerosol nasal, pastillas, microtab | Agonista del receptor nicotínico,[31] de los tipos ganglionar y α4β2.[32] | Tratamiento de la dependencia del tabaco[33] | 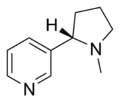
|
| Carbacol | Miostat | 2-[(aminocarbonyl)oxy]-N,N,N-trimethylethanaminium | Solución intraocular | Agonista colinérgico[34] | Tratamiento del glaucoma | 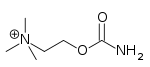
|
| Succinilcolina | Anectine, Quelicin Suxamethonium Chloride | 2,2'-[(1,4-dioxobutane-1,4-diyl)bis(oxy)]bis(N,N,N-trimethylethanaminium) | Inyección intravenosa o intramuscular | Agente bloqueante neuromuscular Depolarizing[35] | Breve acción relajante muscular[36] | |
| Epibatidina | No listado | 2-(6-chloropyridin-3-yl)-7-azabicyclo[2.2.1]heptane | No listado | Agonista del receptor nicotínico de acetilcolina[37] | No se utiliza como droga | 
|
Otros agonistas nicotínicos de uso clínico limitado incluyen:
- Lobeline, un agonista de los receptores nicotínicos ganglionares que afecta también a las terminales nerviosas sensoriales.[32]
- Epibatidine un agonista de los receptores ganglionares, así como de los subtipos α4β2 y α7.[32]
- Decametonio y suxametonio, moléculas que provocan un bloqueo de la despolarización de los receptores de tipo muscular.[32]
Drogas en etapa de estudio
[editar]Un medicamento experimental conocido como AZD0328, fue estudiado entre 2009-2014 como agonista alfa7.
ABT-126 es un agonista del receptor nicotínico α7 estudiado en 2015.
Referencias
[editar]- ↑ Henningfield, Jack E; Zeller, Mitch (2006), «Nicotine psychopharmacology research contributions to United States and global tobacco regulation: a look back and a look forward», Psychopharmacology 184 (3–4): 286-291, PMID 16463054, doi:10.1007/s00213-006-0308-4.
- ↑ a b Haroutunian, Vahram; Barnes, Edward; Davis, KL (1985), «Cholinergie modulation of memory in rats», Psychopharmacology 87 (3): 266-271, PMID 3001803, doi:10.1007/BF00432705.
- ↑ a b c d Buccafusco, J. J. (2004), «Neuronal nicotinic receptor subtypes: defining therapeutic targets», Molecular intervention 4 (5): 285-295, doi:10.1124/mi.4.5.8.
- ↑ Ludwig, J.; Höffle-Maas, A. (2010), «Localization by site-directed mutagenesis of a galantamine binding site on α7 nicotinic acetylcholine receptor extracellular domain», Journal of Receptor and Signal Transduction 30 (6): 469-483, doi:10.3109/10799893.2010.505239.
- ↑ Liu, Zhaoping; Zhang, J; Berg, Darwin K. (2007), «Role of endogenous nicotinic signaling in guiding neuronal development», Biochemical Pharmacology 74 (8): 1112-1119, PMC 2116993, PMID 17603025, doi:10.1016/j.bcp.2007.05.022.
- ↑ «Definición de Acetilcolina». Diccionario ABC. Consultado el 28 de octubre de 2017.
- ↑ a b Gotti, C.; Clementi, F. (2004), «Neuronal nicotinic receptors: from structure to pathology», Progress in Neurobiology 74 (6): 363-396, PMID 15649582, doi:10.1016/j.pneurobio.2004.09.006.
- ↑ a b Paterson, David; Nordberg, Agneta (2000), «Neuronal nicotinic receptors in the human brain», Progress in neurobiology 61 (1): 75-111, PMID 10759066, doi:10.1016/s0301-0082(99)00045-3.
- ↑ Sala, F.; Nistri, A.; Criado, M. (2008), «Nicotinic acetylcholine receptors of adrenal chromaffin cells», Acta Physiologica 192 (2): 203-212, PMID 18005395, doi:10.1111/j.1748-1716.2007.01804.x.
- ↑ Itier, Valérie; Bertrand, Daniel (2001), «Neuronal nicotinic receptors: from protein structure to function», FEBS Letters 504 (3): 118-125, PMID 11532443, doi:10.1016/S0014-5793(01)02702-8.
- ↑ a b Lindstrom, JM (2003), «Nicotinic acetylcholine receptors of muscles and nerves», Annals of the New York Academy of Sciences 998: 41-52, doi:10.1196/annals.1254.007.
- ↑ Unwin, Nigel (2004), «Refined Structure of the Nicotinic Acetylcholine Receptor at 4 A° Resolution», Journal of Molecular Biology 346 (4): 967-989, PMID 15701510, doi:10.1016/j.jmb.2004.12.031.
- ↑ Mihailescu, Stefan; Drucker-Colín, René (2000), «Nicotine, Brain Nicotinic Receptors, and Neuropsychiatric Disorders», Archives of Medical Research 31 (2): 131-144, PMID 10880717, doi:10.1016/S0188-4409(99)00087-9.
- ↑ Arias, Hugo R. (1997), «Topology of ligand binding sites on the nicotinic acetylcholine receptor», Brain Research Reviews 25 (2): 133-191, PMID 9403137, doi:10.1016/S0165-0173(97)00020-9.
- ↑ a b c d Haydar, Simon N.; Ghiron, Chiara; Bettinetti, Laura; Bothman, Hendrick; Comery, Thomas A.; Dunlop, John; La Rosa, Salvatore; Micco, Iolanda; Pollastrini, Martina; Quinn, Joanna; Roncarati, Renza; Scali, Carla; Valacchi, Michela; Varrone, Maurizio; Zanaletti, Riccardo (2009), «SAR and biological evaluation of SEN12333/WAY-317538: Novel alpha 7 nicotinic acetylcholine receptor agonist», Bioorganic & Medicinal Chemistry 17 (14): 5247-5258, PMID 19515567, doi:10.1016/j.bmc.2009.05.040.
- ↑ Brunton, Laurence L.; Lazo, John S.; Parker, Keith L., eds. (2006), Goodman & Gilman‘s The Pharmacological Basis of Therapeutics (11 edición), McGRAW HILL, ISBN 0-07-142280-3.
- ↑ Cassels, Bruce K.; Bermúdez, Isabel; Dajas, Federico; Abin-Carriquiry, J. Andrés; Wonnacott, Susan (2005), «From ligand design to therapeutic efficacy: the challenge for nicotinic receptor research», Drug Discovery Today 10 (23–24): 1657-1665, PMID 16376826, doi:10.1016/S1359-6446(05)03665-2.
- ↑ Gotti, C.; Fornasari, D.; Clementi, F. (1997), «Human Neuronal Nicotinc Receptors», ProgressinNeurobiology 53 (2): 199-237, doi:10.1016/S0301-0082(97)00034-8.
- ↑ Bluma, Angela P.; Lesterb, Henry A.; Dougherty, Dennis A. «Nicotinic pharmacophore: The pyridine N of nicotine and carbonyl of acetylcholine hydrogen bond across a subunit interface to a backbone NH». PNAS 107 (30): 13206-13211. doi:10.1073/pnas.1007140107.
- ↑ Tøndera, Janne E.; Olesena, Preben H.; Hansena, John Bondo; Begtrupb, Mikael; Petterssona, Ingrid (2001), «An improved nicotinic pharmacophore and a stereoselective CoMFA-model for nicotinic agonists acting at the central nicotinic acetylcholine receptors labelled by [3H]-N-methylcarbamylcholine», Journal of Computer-Aided Molecular Design 15 (3): 247-258, PMID 11289078, doi:10.1023/A:1008140021426.
- ↑ Cooper, Julia C.; Gutbrod, Oliver; Witzemann, Veit; Methfessel, Christoph (1996), «Pharmacology of the nicotinic acetylcholine receptor from fetal rat muscle expressed in Xenopus oocytes», European Journal of Pharmacology 309 (3): 287-298, PMID 8874153, doi:10.1016/0014-2999(96)00294-4.
- ↑ Carter, Chris R.J.; Cao, Liren; Kawai, Hideki; Smith, Peter A.; Dryden, William F.; Raftery, Michael A.; Dunn, Susan M.J. (2007), «Chain length dependence of the interactions of bisquaternary ligands with the Torpedo nicotinic acetylcholine receptor», Biochemical Pharmacology 73 (3): 417-426, PMID 17118342, doi:10.1016/j.bcp.2006.10.011.
- ↑ Charton, Yves; Guillonneau, Claude.; Lockhart, Brian; Lestageb, Pierre; Goldsteina, Solo (2008), «Preparation and affinity profile of novel nicotinic ligands», Bioorganic & Medicinal Chemistry Letters 18: 2188-2193, doi:10.1016/j.bmcl.2007.12.075.
- ↑ Walker, Daniel P.; Wishka, Donn G.; Piotrowski, David W.; Jia, Shaojuan; Reitz, Steven C.; Yates, Karen M.; Myers, Jason K.; Vetman, Tatiana N.; Margolis, Brandon J.; Jacobsen, E. Jon; Acker, Brad A.; Groppi, Vincent E.; Wolfe, Mark L.; Thornburgh, Bruce A.; Tinholt, Paula M.; Cortes-Burgos, Luz A.; Walters, Rodney R.; Hester, Matthew R.; Seest, Eric P.; Dolak, Lester A.; Han, Fusen; Olson, Barbara A.; Fitzgerald, Laura; Staton, Brian A.; Raub, Thomas J.; Hajos, Mihaly; Hoffmann, William E.; Li, Kai S.; Higdon, Nicole R. et al. (2006), «Design, synthesis, structure–activity relationship, and in vivo activity of azabicyclic aryl amides as a7 nicotinic acetylcholine receptor agonists», Bioorganic & Medicinal Chemistry 14 (24): 8219-8248, PMID 17011782, doi:10.1016/j.bmc.2006.09.019.
- ↑ http://www.envivopharma.com - Nicotinic Alpha7 Acetylcholine Receptor Agonist Program Archivado el 7 de enero de 2010 en Wayback Machine.
- ↑ Rollema, H.; Chambers, L.K; Coe, J.W.; Glowa, J.; Hurst, R.S.; Lebel, L.A; Lu, Y.; Mansbach, R.S.; Mather, R.J.; Rovetti, C.C.; Sands, S.B.; Schaeffer, E.; Schulz, D.W.; Tangley III, F.D.; Williams, K.E. (2007), «Pharmacological profile of the α4β2 nicotinic acetylcholine receptor partial agonist varenicline, an effective smoking cessation aid», Neuropharmacology 52: 985-994, PMID 17157884, doi:10.1016/j.neuropharm.2006.10.016.
- ↑ Rollema, H.; Chambers, L.K; Coe, J.W.; Glowa, J.; Hurst, R.S.; Lebel, L.A; Lu, Y.; Mansbach, R.S.; Mather, R.J.; Rovetti, C.C.; Sands, S.B.; Schaeffer, E.; Schulz, D.W.; Tangley III, F.D.; Williams, K.E. (2007), «Pharmacological profile of the α4β2 nicotinic acetylcholine receptor partial agonist varenicline, an effective smoking cessation aid», Neuropharmacology 52: 985-994, PMID 17157884, doi:10.1016/j.neuropharm.2006.10.016.
- ↑ a b «http://emc.medicines.org.uk». Archivado desde el original el 24 de diciembre de 2012. Consultado el 24 de septiembre de 2016.
- ↑ Greenblatt, H.M.; Kryger, G.; Lewis, T.; Silman, I.; Sussman, J.L (1999), «Structure of acetylcholinesterase complexed with (-)-galanthamine at 2.3 angstrom resolution», FEBS Letters 463: 321-326, PMID 10606746, doi:10.1016/S0014-5793(99)01637-3.
- ↑ http://emc.mediciness.org/galantamine
- ↑ Dani, John A.; Biasi, Mariella De (2001), «Cellular mechanisms of nicotine addiction», Pharmacology, Biochemistry and Behavior 70: 439-446, doi:10.1016/S0091-3057(01)00652-9.
- ↑ a b c d Rang, H. P. (2003), Pharmacology, Edinburgh: Churchill Livingstone, ISBN 0-443-07145-4. Page 149
- ↑ XI, Zheng-xiong; Spiller, Krista; Gardner, Eliot L. (2009), «Mechanism-based medication development for the treatment of nicotine dependence», Acta Pharmacol Sin 30 (6): 723-739, doi:10.1038/aps.2009.46.
- ↑ http://www.accessdata.fda.gov
- ↑ Tuba, Zoltan; Maho, Sandor; Vizi, E. Sylvester (2002), «Synthesis and Structure-Activity Relationships of Neuromuscular Blocking Agents», Current Medicinal Chemistry 9: 1507-1536, doi:10.2174/0929867023369466.
- ↑ http://emc.medicines.org.uk/suxamethonium
- ↑ Carroll, F. Ivy (2004), «Epibatidine structure-activity relationships», Bioorganic & Medicinal Chemistry Letters 14 (8): 1889-1896, PMID 15050621, doi:10.1016/j.bmcl.2004.02.007.
Enlaces externos
[editar]- MeSH: nicotinic+agonists (en inglés)