Alfaxalona
| Alfaxalona | ||
|---|---|---|
 | ||
 | ||
| Nombre (IUPAC) sistemático | ||
| (3R,5S,8S,9S,10S,13S,14S,17S)-17-acetyl-3-hydroxy-10,13-dimethyl-1,2,3,4,5,6,7,8,9,12,14,15,16,17-tetradecahydrocyclopenta[a]phenanthren-11-one | ||
| Identificadores | ||
| Número CAS | 23930-19-0 | |
| Código ATC | No adjudicado | |
| Código ATCvet | QN01AX05 | |
| PubChem | 104845 | |
| DrugBank | DB11371 | |
| ChemSpider | 94637 | |
| UNII | BD07M97B2A | |
| KEGG | D07282 | |
| ChEMBL | 190279 | |
| Datos químicos | ||
| Fórmula | C21H32O3 | |
| Peso mol. | 332.477 g/mol | |
|
O=C2[C@H]3[C@H]([C@@H]1CC[C@H](C(=O)C)[C@@]1(C)C2)CC[C@H]4C[C@H](O)CC[C@]34C
| ||
|
InChI=1S/C21H32O3/c1-12(22)16-6-7-17-15-5-4-13-10-14(23)8-9-20(13,2)19(15)18(24)11-21(16,17)3/h13-17,19,23H,4-11H2,1-3H3/t13-,14+,15-,16+,17-,19+,20-,21+/m0/s1
Key: DUHUCHOQIDJXAT-OLVMNOGESA-N | ||
| Farmacocinética | ||
| Unión proteica | 30-50% | |
| Metabolismo | Hepático | |
| Vida media |
| |
| Excreción | En mayor parte renal | |
| Datos clínicos | ||
| Nombre comercial | Alfaxan | |
| Estado legal | S4 (AU) ℞-only (CA) Lista IV (EUA) | |
La alfaxalona es un neuroesteroide y anestésico general.[1][2] Es utilizada por los veterinarios con el nombre comercial Alfaxan[3] como un agente de inducción de la anestesia vía intravenosa. Aunque es más cara que otros agentes de inducción, se la prefiere a menudo por la ausencia de efectos depresivos en el sistema cardiovascular.[4] El efecto secundario más común es la apnea; cuando no va precedido por una premedicación con sedantes, tranquilizantes u opioides, los pacientes también pueden llegar a presentar agitación y sensación de hipersensibilidad.
La alfaxalona funciona como modulador alostérico positivo en los receptores de GABAA y en concentraciones altas como agonista directo. El hígado lo quita rápidamente, dándole una semivida de eliminación corta e impide que se acumule en el cuerpo, bajando la probabilidad de sobredosis.
Uso médico
[editar]Se usa la alfaxalona como agente de inducción, anestésico inyectable y como sedante en animales.[5] Pese a que se usa generalmente en gatos y perros, también ha sido exitoso el uso en conejos,[6] caballos, ovejas, cerdos y animales exóticos como la jicotea elegante, el ajolote, la iguana verde, el tití y la carpa.[7][8] En su uso como agente de inducción, la alfaxalona hace que el animal se relaje lo suficiente para ser intubado; después se puede dar el anestésico inhalante. Administrar la premedicación aumenta la potencia de la alfaxalona como agente de inducción.[7] Se la puede utilizar en vez de anestésicos inhalantes en cirugías que duran menos de 30 minutos, como una infusión constante—esto es especialmente útil en procedimientos como lasbroncoscopias o reparaciones de rasgaduras tráqueales.[4][9]
Cuando se da la alfaxalona como inyección intramusuclar (IM), se emplea como sedante, aunque esto requiere un volumen más grande (no todos países permiten la administración de esta molécula vía IM ).[10][11]
La alfaxalona no tiene propiedades analgésicas.[7]
Formas disponibles
[editar]Aunque la alfaxalona no es autorizada para uso intramuscular o subcutáneo en los Estados Unidos (porque ambos causan recuperaciones más largas con más agitación y hipersensibilidad a estímulos), se la da frecuentemente vía IM en gatos, y está autorizada como tal en otros países.[4][12]
La alfaxalona se disuelve en 2-hidroxipropill-β ciclodextrina (que es tóxico para las personas);[13] la ciclodextrina es una molécula grande derivada de almidón con un núcleo hidrófobo donde la alfaxalona se une, permitiendo que esta se disuelva en agua. Así, se puede vender como disolución acuosa. La ciclodextrina y la alfaxalona actúan como una unidad, y solo se disocian cuando llegan al cuerpo.[10][14]
La falta de preservantes en viales de alfaxalona le da un tiempo de caducidad extremamente corto cuando el sello se rompe roto porque los microbios pueden crecer dentro del vial.[13] Las instrucciones oficiales del Reino Unido dictan que se tome la cantidad necesaria y se deseche el resto inmediatamente. En los Estados Unidos, un vial de alfaxalona puede ser mantenido hasta seis horas después de su primer uso.[11] En Nueva Zelanda y Australia, un vial abierto puede ser mantenido en el refrigerador hasta siete días.[12]
Poblaciones específicas
[editar]Se ha usado alfaxalona para hacer cesáreas en gatas embarazadas: aunque atraviesa la placenta y tiene algunos efectos en las crías, no hay depresión respiratoria ni efecto duradero. También se ha notado que es segura para usar en cachorros y gatos jóvenes.[15][16]
Se considera que la alfaxalona es un agente anestésico bueno para los perros con trastornos de ritmo cardíaco y para los lebreles.[12][17]
Efectos secundarios
[editar]La alfaxalona tiene relativamente pocos efectos secundarios en comparación con otros anestésicos; destaca la falta de depresión cardiovascular en dosis clínicas, lo que la hace única entre anestésicos.[18][12] El efecto secundario más común es la depresión respiratoria: además de la apnea—lo más prevalente—, la alfaxalona puede disminuir el índice respiratorio, volumen por minuto, y saturación de oxígeno en la sangre en gatos y perros.[16] La alfaxalona debe ser administrada por un periodo de al menos 60 segundos o hasta que la anestesia esté inducida; la administración rápida aumenta el riesgo de apnea.[5][12] La alfaxalona tiene algunos efectos depresivos en el sistema nervioso central, incluyendo la reducción de la circulación cerebral, la presión craneoencefálica y la temperatura.[16]
Los galgos —que son más susceptibles a efectos secundarios anestésicos— pueden tener un suministro de sangre y oxígeno disminuido en el hígado.[16]
Cuándo no se dan premedicaciones, la alfaxalona causa que los animales (especialmente el gato) estén agitados cuándo se recuperan.[4][12] Los perros y gatos hacen movimientos de nado en el aire, vocalizan excesivamente, tienen reacciones exageradas a estímulos externos como la luz o el ruido, y pueden quedarse rígidos o crisparse. Por esta razón, se recomienda que durante la recuperación de la anestesia por alfaxalona estén en un área tranquila y oscura.[16]
Sobredosis
[editar]El metabolismo y la eliminación rápida de la alfaxalona reducen la posibilidad de sobredosis.[18] Se necesitan más de 28 veces de la dosis normal para causar toxicidad en gatos. Tales dosis siguen pudiendo causar presión de sangre baja, apnea, hipoxia y arritmia (causada por la apnea y la hipoxia).[10]
Farmacología
[editar]Mecanismo de acción
[editar]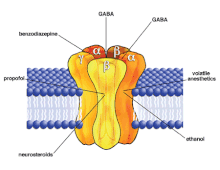
La alfaxalona es un esteroide neuroactivo que deriva de la progesterona, aunque no actúa como glucocorticoide o mineralocorticoide. En su lugar, interactúa con los receptores de GABAA.[19] Se une a los dominios M3/M4 de la subunidad α y modifica el receptor de manera alostérica para facilitar el movimiento de iones de cloruro a la célula, que resulta en la hiperpolarización del nervio post-sináptico (que cuasa la inhibición de potenciales de acción). En concentraciones por encima de 1 micromolar,[20] la alfaxalona se une a un sitio de la interfaz entre las subunidades α y β (cerca del sitio donde el GABA se une) y actúa como agonista de manera similar que las benzodiazepinas.[16][21] Sin embargo, la alfaxalona no comparte el sitio de unión de la benzodiazepina, y prefiere diferentes receptores de GABAA que las benzodiazepenas—interactúa más en la isoforma α1-β2-γ2-L.[22] Las investigaciones sugieren que los esteroides neuroactivos aumentan la expresión de los receptores GABAA , haciendo más difícil que desarrollen tolerancia.[21]
Farmacocinética
[editar]La alfaxalona se metaboliza rápidamente y no se acumula en el cuerpo; de esta manera su uso como agente de inducción no aumenta el tiempo necesario para recuperarse de la anestesia.[4][18] Si administrada más despacio por dilución en agua estéril, se puede usar menos alfaxalona.[9] Une a 30%-50% de proteínas del plasma,[23] y tiene una vida media de 25 minutos en perros y 45 minutos en los gatos con dosis clínicas (2 mg/kg y 5 mg/kg respectivamente). La farmacocinética de la alfaxalona no es linear en gatos o perros.[13][24]
La mayoría de la alfaxalona se metaboliza en el hígado, aunque una parte tiene lugar en los pulmones y riñones.[24] En el hígado, experimenta ambos metabolismos de fase I (dependiente en citocromo P450) y de fase II (dependiente en la conjugación). Los productos de a fase I son iguales en gatos y perros: alopregnatriona, 3β-alfaxalona, 20-hidroxi-3β-alfaxalona, 2-hidroxialfaxalona, y 2α-hidroxialfaxalona.[10][16] En perros, los metabolitos de la fase II metabolitos son alfaxalona glucurónida (el metabolito mayor), sulfato de 20-hidroxialfaxalona y 2α-hidroxialfaxalona glucurónida. En gatos, hay una producción más grande de sulfato de 20-hidroxialfaxalona que de alfaxalona glucurónida; los gatos también tienen 3β-alfaxalona-sulfato, la cual no se presenta en perros.[10][16]
La alfaxalona se excreta mayoritariamente en la orina, aunque también se excreta un poco en la bilis.
Química
[editar]
La alfaxalona es un sintético esteroide derivado de la progesterona. Específicamente, hay una modificación en la cetona de C3 de la progesterona que lareduce a un grupo hidróxilo. El doble enlace entre C4 y C5 ha sido reducido a un enlace sencillo y una cetona ha sido sustituida en C11. La alfaxalona es también un derivado de la alopregnanolona, con la que se difieren solo por adición de la cetona en C11. Otros esteroides relacionados estrechamente incluyen la ganaxolona, hidroxidiona, minaxolona, pregnanolona y renanolona.[1]
Historia
[editar]En 1941, se ha descubierto la que progesterona y 5β-pregnanediona tenían efectos depresivos en el sistema nervioso central de los roedores. Esto inició una búsqueda para sintetizar un esteroide que se pueda utilizar como anestésico. La mayoría de estos esfuerzos apuntaron en hacer la alfaxalona más soluble en agua.[21]
En 1971, una combinación de alfaxalona y el acetato de alfadolona se hizo pública con los nombres de Althesin (para uso humano) y Saffan (para uso veterinario).[7][24] Ambos fueron disueltos en Cremophor EL, un tensoactivo de aceite de ricino polioxietilado.[13]
Althesin fue retirado del mercado en 1984 por causar anafilaxia; posteriormente se descubrió que esto era debido al Cremphor EL, que causó la liberación de histamina más que de alfaxolona o alfadolona.[7][12][21] Saffan fue retirado del uso para perros, pero se quedó disponible para otros animales, porque ninguno de ellos presentaba liberación de histamina en cantidad como en los perros.[25] Todavía es valorado en gatos por la falta de efectos depresivos en el sistema cardiovascular, lo que lo hizo tres veces menos fatal que cualquier otro anestésico en el mercado en esa época.[7][9] La liberación de histamina hizo que la mayoría de gatos (70%) tuviera edema e hiperemia en las orejas y las patas;[26] solo algunos tuvieron además edema en la laringe o en los pulmones.[25]
En 1999, una forma liofilizada de alfaxalone se hizo pública para gatos.[10] El fármaco nuevo, Alfaxan, utilizó ciclodextrina en vez de Camphor EL como agente cargador, para hacer la alfaxalona más soluble en agua.[12] No se incluyó alfadolona en la mezcla, porque sus efectos sedantes eran bastante débiles.[25] Se introdujo una forma acuosa de Alfaxan en el mercado en Australia en 2000-2001 y finalmente, se retiró Saffan del mercado en 2002. Se puso Alfaxan en el mercado en el Reino Unido en 2007, Europa central en 2008, Canadá en 2011, y los Estados Unidos en 2012.[10][11]
Actualmente, una forma de alfaxalona para uso en humanos está en desarrollo bajo el nombre «Phaxan», que se disolverá en 7-sulfo-butilo-éter-β-cyclodextrina, el cual, a diferencia de la ciclodextrina utilizada en Alfaxan, no es tóxico a personas.[13]
Nombres de marca
[editar]Alfaxalona era vendida en 1971 en combinación con alfadolone acetato bajo el nombre de marca Althesin para uso humano y Saffan para uso veterinario.[16][27] Althesin fue retirado del mercado en 1984, mientras que Saffan sigue siendo vendido.[28] Una formulación nueva que contiene alfaxalona solo estuvo introducida para uso veterinario en 1999 bajo el nombre de marca Alfaxan. Siguiendo la introducción de Alfaxan, Saffan era gradualmente interrumpido y ahora ya no se comercializa.[29] Otra formula nueva que contiene alfaxalona está actualmente bajo desarrollo para uso en humanos con el nombre de marca provisional Phaxan.[30]
Disponibilidad
[editar]La alfaxalona es comercializada para uso veterinario bajo el nombre de marca Alfaxan en varios países, incluyendo Australia, Bélgica, Canadá, Francia, Alemania, Irlanda, Japón, el Netherlands, Nueva Zelanda, Sudáfrica, Corea del Sur, España, Taiwán, el Reino Unido, y los Estados Unidos.[31][32]
Referencias
[editar]- ↑ a b The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies [El diccionario de fármacos: Datos químicos: Datos químicos, estructura y referencias] (en inglés). Springer. 14 de noviembre de 2014. pp. 664-. ISBN 978-1-4757-2085-3.
- ↑ Concise Dictionary of Pharmacological Agents: Properties and Synonyms [Diccionario conciso de agentes fármacos: propiedades y sinónimos] (en inglés). Springer Science & Business Media. 6diciembre de 2012. p. 11. ISBN 978-94-011-4439-1.
- ↑ «Alfaxalone» (en inglés). Drugs.com.
- ↑ a b c d e Rezende, Marlis (junio de 2015). «Reintroduced Anesthetic Alfaxalone» [La anestética reintroducida alfaxalona]. Clinician's Brief (en inglés). Archivado desde el original el 23 de julio de 2015. Consultado el 14 de julio de 2017.
- ↑ a b Biblioteca Nacional de Medicina de los Estados Unidos. «ALFAXAN – alfaxalone injection, solution». DailyMed (en inglés). Consultado el 15 de julio de 2017.
- ↑ Varga, Molly (2014). «Chapter 4: Anaesthesia and Analgesia». Textbook of Rabbit Medicine [Libro de texto de la medicina de conejos] (en inglés) (2º edición). Butterworth-Heinemann. pp. 178-202. ISBN 9780702049798.
- ↑ a b c d e f Clarke, K. W.; Trim, C. M.; Hall, L. W., eds. (2014). «Chapter 6: General pharmacology of the injectable agents used in anaesthesia» [Farmacología general de los agentes inyectables usados en la anestesia]. Veterinary Anaesthesia [Anestesia veterinaria] (en inglés) (11º edición). Oxford: W.B. Saunders. pp. 135-153. ISBN 9780702027932. doi:10.1016/B978-0-7020-2793-2.00006-2.
- ↑ Minter, Larry J; Bailey, Kate M; Harms, Craig A; Lewbart, Gregory A; Posner, Lysa P (1 de julio de 2014). «The efficacy of alfaxalone for immersion anesthesia in koi carp (Cyprinus carpio)» [La eficaz de alfaxalona para la anestesia de inmersión en la carpa (Cyprinus carpio)]. Veterinary Anaesthesia and Analgesia [Anastesia y analgesia veterinarias] (en inglés) 41 (4): 398-405. ISSN 1467-2987. PMID 24754530. doi:10.1111/vaa.12113.
- ↑ a b c Clarke, K. W.; Trim, C. M.; Hall, L. W., eds. (2014). «Chapter 16: Anaesthesia of the cat» [La anestesia del gato]. Veterinary Anaesthesia [Anastesia veterinaria] (en inglés) (11º edición). Oxford: W.B. Saunders. pp. 499-534. ISBN 9780702027932. doi:10.1016/B978-0-7020-2793-2.00016-5.
- ↑ a b c d e f g Warne, Leon N.; Beths, Thierry; Whittem, Ted; Carter, Jennifer E.; Bauquier, Sébastien H. (2 de enero de 2015). «A review of the pharmacology and clinical application of alfaxalone in cats» [Una revista de la farmacología y aplicación clínica de alfaxalona en gatos]. The Veterinary Journal (en inglés) 203 (2): 141-148. ISSN 1090-0233. doi:10.1016/j.tvjl.2014.12.011.
- ↑ a b c Zeltzman, Phil (17 de noviembre de 2014). «Why Administering Alfaxalone Requires A Bit of Education» [Porqué administrar alfaxalona requiere algo de educación]. Veterinary Practice News (en inglés). Consultado el 14 de julio de 2017.
- ↑ a b c d e f g h Nieuwendijk, Hans (marzo de 2011). «Alfaxalone». Veterinary Anesthesia & Analgesia Support Group (en inglés). Consultado el 14 de julio de 2017.
- ↑ a b c d e Absalom, Anthony R.; Mason, Keira P. (1 de marzo de 2017). Total Intravenous Anesthesia and Target Controlled Infusions: A Comprehensive Global Anthology [Anestesia total intravenosa y infusiones controladas: una antología comprehensiva y global] (en inglés). Springer. pp. 31, 306. ISBN 9783319476094.
- ↑ Klöppel, Heide; Leece, Elizabeth A (enero de 2011). «Comparison of ketamine and alfaxalone for induction and maintenance of anaesthesia in ponies undergoing castration» [Comparar la ketamina y la alfaxalona para la inducción y el mantenimiento de anestesia en los ponis recibiendo la castración]. Veterinary Anaesthesia and Analgesia (en inglés) 38 (1): 37-43. ISSN 1467-2987. PMID 21214708. doi:10.1111/j.1467-2995.2010.00584.x.
- ↑ Clarke, K. W.; Trim, C. M.; Hall, L. W., eds. (2014). «Chapter 19: Anaesthesia for obstetrics» [La anestesia obstétrica]. Veterinary Anaesthesia [Anestesia veterinaria] (en inglés) (11º edición). Oxford: W.B. Saunders. pp. 587-598. ISBN 9780702027932. doi:10.1016/B978-0-7020-2793-2.00019-0.
- ↑ a b c d e f g h i Grimm, Kurt A.; Lamont, Leigh A.; Tranquilli, William J.; Greene, Stephen A.; Robertson, Sheilah A. (2015). Veterinary Anesthesia and Analgesia [Anestesia y analgesia veterinaria] (en inglés) (5º edición). John Wiley & Sons. pp. 289-290. ISBN 9781118526200.
- ↑ Clarke, K. W.; Trim, C. M.; Hall, L. W., eds. (2014). «Chapter 15: Anaesthesia of the dog» [La anestesia del perro]. Veterinary Anaesthesia [Anestesia veterinaria] (en inglés) (11º edición). Oxford: W.B. Saunders. pp. 135-153. ISBN 9780702027932. doi:10.1016/B978-0-7020-2793-2.00015-3.
- ↑ a b c Ferré, Pierre J.; Pasloske, Kirby; Whittem, Ted; Ranasinghe, Millagahamanda G.; Li, Qiang; Lefebvre, Hervé P. (2006). «Plasma pharmacokinetics of alfaxalone in dogs after an intravenous bolus of Alfaxan-CD RTU» [Farmacocinética plasmática de alfaxalona en el perro después de un bolo intravenoso de Alfaxxan-CD RTU]. Veterinary Anaesthesia and Analgesia [Anestesia y analgesia veterinaria] (en inglés) 33 (4): 229-236. ISSN 1467-2987. doi:10.1111/j.1467-2995.2005.00264.x.
- ↑ Harrison, N. L.; Vicini, S.; Barker, J. L. (1987). «A steroid anesthetic prolongs inhibitory postsynaptic currents in cultured rat hippocampal neurons» [Un anestésico esteroide prolonga las corrientes inhibitorias post-sinápticas en los nervios cultivado del hipocampo del ratón] (pdf). Journal of Neuroscience [Revista de neurociencia] (en inglés) 7 (2): 604-609. PMID 3819824.
- ↑ Visser, S. a. G.; Smulders, C. J. G. M.; Reijers, B. P. R.; Graaf, P. H. van der; Peletier, L. A.; Danhof, M. (1 de septiembre de 2002). «Mechanism-Based Pharmacokinetic-Pharmacodynamic Modeling of Concentration-Dependent Hysteresis and Biphasic Electroencephalogram Effects of Alphaxalone in Rats». Journal of Pharmacology and Experimental Therapeutics (en inglés) 302 (3): 1158-1167. ISSN 0022-3565. PMID 12183676. doi:10.1124/jpet.302.3.1158.
- ↑ a b c d Martinez-Botella, Gabriel; Ackley, Michael A.; Salituro, Francesco G.; Doherty, James J. (1 de enero de 2014). «Natural and Synthetic Neuroactive Steroid Modulators of GABAA and NMDA Receptors» [Moduladores esteroides neuroactivos natural y syntética de los receptores de GABAA y NMDA]. Annual Reports in Medicinal Chemistry [Reportas anuales de la química médica]. Annual Reports in Medicinal Chemistry (en inglés) 49: 27-42. ISBN 9780128003725. ISSN 0065-7743. doi:10.1016/B978-0-12-800167-7.00003-1.
- ↑ Mihic, S. J.; Whiting, P. J.; Klein, R. L.; Wafford, K. A.; Harris, R. A. (1994). «A single amino acid of the human gamma-aminobutyric acid type A receptor gamma 2 subunit determines benzodiazepine efficacy» [Un único amino ácido del receptor de gamma-aminobutírico humano tipo A subunidad gama 2 determina la eficaz de las benzodiazepinas] (pdf). The Journal of Biological Chemistry [Revista de química biológica] (en inglés) 269 (52): 32768-32773. PMID 7806498.
- ↑ Maddison, Jill E.; Page, Stephen W.; Church, David, eds. (2008). «Alphaxalone (±alphadolone)». Small Animal Clinical Pharmacology [Farmacología clínica de animales pequeños] (en inglés). Elsevier Health Sciences. pp. 101-103. ISBN 9780702028588.
- ↑ a b c Suarez, Martin A; Dzikiti, Brighton T; Stegmann, Frik G; Hartman, Marthinus (mayo de 2012). «Comparison of alfaxalone and propofol administered as total intravenous anaesthesia for ovariohysterectomy in dogs» [Comparación entre alfaxalona y propofol administrados como anestesia intravenosa total para la ooforectamía]. Veterinary Anaesthesia and Analgesia (en inglés) 39 (3): 236-244. ISSN 1467-2987. doi:10.1111/j.1467-2995.2011.00700.x.
- ↑ a b c Welsh, Liz (8 de mayo de 2013). Anaesthesia for Veterinary Nurses (en inglés). John Wiley & Sons. p. 153. ISBN 9781118693148.
- ↑ Liao, PenTing (agosto de 2016). Anesthetic and Cardio-pulmonary Effects of Propofol or Alfaxalone with or without Midazolam Co-Induction in Fentanyl Sedated Dogs [Efectos anestésicos y cardiopulmonares de propofol o alfaxalona sin o con la inducción de con midazolam en perros sedados con fentanilo] (DVM) (en inglés). Guelph, Ontario: Universidad de Guelph.
- ↑ Saunders Handbook of Veterinary Drugs: Small and Large Animal. Elsevier Health Sciences. octubre de 2015. pp. 17-18. ISBN 978-0-323-24485-5.
- ↑ Clarke, Kathy W.; Trim, Cynthia M. (28 de junio de 2013). Veterinary Anaesthesia E-Book [E-Libro de la anestesia veterinaria] (en inglés). Elsevier Health Sciences. p. 143. ISBN 978-0-7020-5423-5.
- ↑ Fish, Richard E. (2008). Anesthesia and Analgesia in Laboratory Animals [Anestesia y analgesia en animales del laboratorio url=https://books.google.com/books?id=zMfSuAuyKwUC&pg=PA315]. Academic Press. pp. 315–. ISBN 978-0-12-373898-1.
- ↑ «Alfaxalone (PHAX-001; Phaxan)». AdisInsight. Consultado el 27 de julio de 2017.
- ↑ «Official website of Alfaxan» (en inglés). Archivado desde el original el 15 de enero de 2018. Consultado el 15 de enero de 2018.
- ↑ Tamura, Jun; Ishizuka, Tomohito; Fukui, Sho; Oyama, Norihiko; Kawase, Kodai; Miyoshi, Kenjiro; Sano, Tadashi; Pasloske, Kirby et al. (2015). «The pharmacological effects of the anesthetic alfaxalone after intramuscular administration to dogs» [Los efectos fármacos del anestésico alfaxalona después de administración intramuscular a perros]. The Journal of Veterinary Medical Science [La revista de ciencias médicas veterinarias] (en inglés) 77 (3): 289-296. ISSN 0916-7250. PMC 4383774. doi:10.1292/jvms.14-0368.