Anticuerpo humanizado
Los anticuerpos humanizados son anticuerpos de especies no humanas cuyas secuencias proteicas han sido modificadas para aumentar su similitud con las variantes de anticuerpos producidas naturalmente en los seres humanos.[1][2] El proceso de "humanización" se aplica generalmente a los anticuerpos monoclonales desarrollados para su administración a seres humanos (por ejemplo, anticuerpos desarrollados como fármacos contra el cáncer). La humanización puede ser necesaria cuando el proceso de desarrollo de un anticuerpo específico implica la generación en un sistema inmunológico no humano (como el de los ratones). Las secuencias proteínicas de los anticuerpos producidos de este modo son parcialmente distintas de los anticuerpos homólogos que se producen de forma natural en los seres humanos, por lo que son potencialmente inmunogénicos cuando se administran a pacientes humanos. Existen otros tipos de anticuerpos desarrollados. Las Denominaciones Comunes Internacionales de los anticuerpos humanizados terminan en -zumab, como en omalizumab (véase Nomenclatura de los anticuerpos monoclonales).
Los anticuerpos humanizados son distintos de los anticuerpos quiméricos. Estos últimos también tienen sus secuencias de proteínas más parecidas a las de los anticuerpos humanos, pero llevan un tramo mayor de proteínas no humanas.
Uso de ADN recombinante en el proceso de humanización
[editar]El proceso de humanización aprovecha el hecho de que la producción de anticuerpos monoclonales puede llevarse a cabo utilizando ADN recombinante para crear construcciones[3] capaces de expresarse en cultivos de células de mamíferos. Es decir, se aíslan segmentos de genes capaces de producir anticuerpos y se clonan en células que pueden cultivarse en un biorreactor, de modo que las proteínas de anticuerpos producidas a partir del ADN de los genes clonados pueden cosecharse en masa. El paso que implica el ADN recombinante proporciona un punto de intervención que puede aprovecharse fácilmente para alterar la secuencia proteica del anticuerpo expresado. Por lo tanto, todas las alteraciones de la estructura del anticuerpo que se consiguen en el proceso de humanización se efectúan mediante técnicas a nivel del ADN. No todos los métodos para derivar anticuerpos destinados a la terapia humana requieren un paso de humanización (por ejemplo, la visualización de fagos), pero esencialmente todos dependen de técnicas que permiten, de manera similar, la "inserción" o el "intercambio" de partes de la molécula del anticuerpo.
Distinción de "anticuerpo quimérico"
[editar]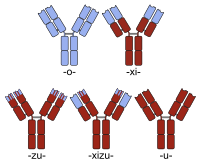
La humanización suele considerarse distinta de la creación de una quimera de anticuerpos de ratón y humanos. Así, aunque la creación de una quimera de anticuerpos se realiza normalmente para conseguir un anticuerpo más parecido al humano (sustituyendo la región constante del anticuerpo de ratón por la del humano), las quimeras simples de este tipo no suelen denominarse humanizadas. Más bien, la secuencia proteica de un anticuerpo humanizado es esencialmente idéntica a la de una variante humana, a pesar del origen no humano de algunos de sus segmentos de la región determinante de la complementariedad (CDR) responsables de la capacidad del anticuerpo para unirse a su antígeno diana.
Los nombres de anticuerpos quiméricos contienen una raíz -xi-. Ejemplos de anticuerpos quiméricos aprobados para terapia humana incluyen abciximab (ReoPro), basiliximab (Simulect), cetuximab (Erbitux), infliximab (Remicade) y rituximab (MabThera). También hay varios ejemplos de quiméricos actualmente en ensayos clínicos (por ejemplo , bavituximab, consulte la lista clasificable para obtener ejemplos adicionales).
Humanización a través de un intermediario quimérico
[editar]El proceso de humanización también puede incluir la creación de una quimera ratón-humano como paso inicial. En este caso, se empalma una región variable de ratón con una región constante humana. A continuación, la quimera puede humanizarse aún más alterando selectivamente la secuencia de aminoácidos en la región variable de la molécula.
El proceso de alteración debe ser "selectivo" para conservar la especificidad para la que se desarrolló originalmente el anticuerpo. Es decir, dado que las porciones CDR de la región variable son esenciales para la capacidad del anticuerpo de unirse a su objetivo previsto, los aminoácidos de estas porciones no pueden ser alterados sin el riesgo de socavar el propósito del desarrollo. Aparte de los segmentos CDR, las porciones de las regiones variables que difieren de las de los humanos pueden corregirse intercambiando los aminoácidos individuales apropiados. Esto se consigue a nivel del ADN mediante mutagénesis.
La denominación de quimeras humanizadas incluye la raíz de ambas designaciones ( -xi- + -zu- ). El Otelixizumab es un ejemplo de quimera humanizada que se encuentra actualmente en ensayos clínicos para el tratamiento de la artritis reumatoide y la diabetes mellitus.[4]
Humanización mediante la inserción de CDR relevantes en el "andamio" del anticuerpo humano
[editar]Es posible producir un anticuerpo humanizado sin crear un intermedio quimérico. La creación "directa" de un anticuerpo humanizado puede lograrse insertando los segmentos de codificación CDR apropiados (llamados "donantes", responsables de las propiedades de unión deseadas) en un "andamio" de anticuerpo humano (llamado "aceptor"). Como se ha comentado anteriormente, esto se consigue mediante métodos de ADN recombinante utilizando un vector[3] y expresión en células de mamíferos. Es decir, después de que se desarrolle un anticuerpo para que tenga las propiedades deseadas en un ratón (u otro no humano), el ADN que codifica ese anticuerpo puede aislarse, clonarse en un vector y secuenciarse . A continuación, se puede determinar la secuencia de ADN correspondiente a las CDR del anticuerpo. Una vez que se conoce la secuencia precisa de las CDR deseadas, se puede idear una estrategia para insertar estas secuencias de manera apropiada en una construcción que contiene el ADN de una variante de anticuerpo humano.[5][6] La estrategia también puede emplear la síntesis de fragmentos de ADN lineales basada en la lectura de secuencias de CDR.
El Alemtuzumab es un ejemplo temprano de un anticuerpo cuya humanización no incluyó un intermediario quimérico. En este caso, se desarrolló un monoclonal denominado "Campath-1" para que se uniera a CD52 mediante un sistema de ratón. Los bucles hipervariables de Campath-1 (que contienen sus CDR y, por tanto, le confieren su capacidad de unirse a CD52) se extrajeron y se insertaron en un marco de anticuerpos humanos[1] Alemtuzumab está aprobado para el tratamiento de la leucemia linfocítica crónica de células B[7] y actualmente se encuentra en ensayos clínicos para otras afecciones, como la esclerosis múltiple.[8]
Derivación de fuentes distintas a los ratones
[editar]Existen tecnologías que evitan por completo el uso de ratones u otros mamíferos no humanos en el proceso de descubrimiento de anticuerpos para terapia humana. Los ejemplos de tales sistemas incluyen varios métodos de "presentación" (principalmente visualización de fagos ) así como métodos que explotan los niveles elevados de células B que ocurren durante una respuesta inmune humana.
Métodos de visualización
[editar]En ellos se emplean los principios selectivos de la producción de anticuerpos específicos, pero se aprovechan los microorganismos (como en la visualización de fagos) o incluso los extractos libres de células (como en la visualización de ribosomas). Estos sistemas se basan en la creación de "bibliotecas" de genes de anticuerpos que pueden derivarse en su totalidad del ARN humano aislado de la sangre periférica. Los productos inmediatos de estos sistemas son fragmentos de anticuerpos, normalmente Fab o scFv.
Esto significa que, aunque los fragmentos de anticuerpos creados mediante métodos de visualización son de secuencia totalmente humana, no son anticuerpos completos. Por lo tanto, se utilizan procesos esencialmente idénticos a la humanización para incorporar y expresar las afinidades derivadas dentro de un anticuerpo completo.
Adalimumab (Humira) es un ejemplo de anticuerpo aprobado para terapia humana que se creó mediante la visualización de fagos .[9][10]
Anticuerpos de pacientes humanos o receptores de vacunas
[editar]Es posible explotar la reacción inmunitaria humana en el descubrimiento de anticuerpos monoclonales. En pocas palabras, la respuesta inmunitaria humana funciona de la misma manera que la de un ratón u otro mamífero no humano. Por lo tanto, las personas que experimentan un desafío a su sistema inmunitario, como una enfermedad infecciosa, un cáncer o una vacuna, son una fuente potencial de anticuerpos monoclonales dirigidos a ese desafío. Este enfoque parece especialmente adecuado para el desarrollo de terapias antivirales que exploten los principios de la inmunidad pasiva. En principio, se han demostrado variantes de este enfoque[11] y algunas de ellas se están desarrollando comercialmente.[12]
Referencias
[editar]- ↑ a b «Reshaping human antibodies for therapy». Nature 332 (6162): 323-7. 1988. PMID 3127726. doi:10.1038/332323a0.
- ↑ «A humanized antibody that binds to the interleukin 2 receptor.». Proc Natl Acad Sci U S A 86 (24): 10029-33. Dec 1989. PMC 298637. PMID 2513570. doi:10.1073/pnas.86.24.10029. (This is an early example of the use of the term "humanized antibody".)
- ↑ a b «Versatile vectors for transient and stable expression of recombinant antibody molecules in mammalian cells.». J Immunol Methods 204 (1): 77-87. May 1997. PMID 9202712. doi:10.1016/S0022-1759(97)00034-3.
- ↑ Clinical Trials page list for otelixizumab
- ↑ «SDR graftinga new approach to antibody humanization.». Methods 36 (1): 25-34. May 2005. PMID 15848072. doi:10.1016/j.ymeth.2005.01.003.
- ↑ «Humanization of an anti-CD34 monoclonal antibody by complementarity-determining region grafting based on computer-assisted molecular modeling.». J Biochem 144 (1): 115-20. July 2008. PMID 18424812. doi:10.1093/jb/mvn052.
- ↑ DrugBank entry for alemtuzumab
- ↑ Clinical Trials pages for alemtuzumab
- ↑ Kempeni J. (Nov 1999). «Preliminary results of early clinical trials with the fully human anti-TNFalpha monoclonal antibody D2E7». Ann Rheum Dis 58 (Suppl 1): I70-2. PMC 1766582. PMID 10577977. doi:10.1136/ard.58.2008.i70.
- ↑ Rau R (Nov 2002). «Adalimumab (a fully human anti-tumour necrosis factor alpha monoclonal antibody) in the treatment of active rheumatoid arthritis: the initial results of five trials». Ann Rheum Dis 61 (Suppl 2): 70-3. PMC 1766697. PMID 12379628. doi:10.1136/ard.61.suppl_2.ii70.
- ↑ Stacy JE, Kausmally L, Simonsen B, Nordgard SH, Alsøe L, Michaelsen TE, Brekke OH (Dec 2003). «Direct isolation of recombinant human antibodies against group B Neisseria meningitidis from scFv expression libraries». J Immunol Methods 283 (1–2): 247-59. PMID 14659916. doi:10.1016/j.jim.2003.09.015.
- ↑ http://www.theraclone-sciences.com/pdf/Theraclone_ISTAR.pdf Archivado el 3 de marzo de 2016 en Wayback Machine. Example of method using human patients as source of monoclonal antibodies