Dermatitis herpetiforme
| Dermatitis herpetiforme | ||
|---|---|---|
 Dermatitis herpetiforme en abdomen | ||
| Especialidad | dermatología | |
| Sinónimos | ||
| ||






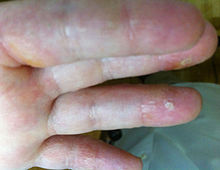
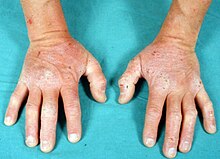


La dermatitis herpetiforme (DH), también conocida como enfermedad de Duhring-Brocq[1][2] se trata de una afectación cutánea de naturaleza inflamatoria y autoinmunitaria, que presenta unos típicos hallazgos histopatológicos e inmunopatológicos, que ayudan a confirmar su diagnóstico.[3] Es la manifestación en la piel de la enfermedad celíaca.[4][5][6]
Clínicamente se caracteriza por la presencia de múltiples lesiones cutáneas intensamente pruriginosas, muy polimórficas, con un curso evolutivo crónico-recurrente, que pueden aparecer diseminadas o en grupos. Se presentan como lesiones eritematosas, placas de urticaria, pápulas, vesículas y ampollas, que derivan en erosiones, excoriaciones o hiperpigmentación de la piel.[3]
Las lesiones cutáneas suelen aparecer principalmente en zonas de roce o de frecuentes pequeños traumatismos, tales como la superficie extensora de codos, rodillas, nalgas[3] y cuero cabelludo,[7] aunque otras zonas pueden también estar afectadas.[3] Es característica la distribución simétrica de las lesiones.[3]
La enfermedad tiende a evolucionar con períodos de agudización y remisión, variables en frecuencia e intensidad.[1]
Diversas investigaciones sobre la DH han demostrado que no es solo una enfermedad ampollosa de la piel, sino que se trata de un trastorno cutáneo-intestinal causado por una intolerancia al gluten de la dieta.[1] Todos los pacientes con DH presentan diversos problemas relacionados con la ingestión de alimentos que contienen gluten, si bien solo una minoría experimenta síntomas digestivos.[1][2]
Su tratamiento consiste en la supresión permanente del gluten de la alimentación con el seguimiento de una dieta sin gluten estricta (DSG).[5][1][8] Puede ser aconsejable el tratamiento temporal con dapsona[5][1] u otras sulfonas,[1] para reducir la sintomatología hasta que la DSG inicia su efecto.[8][9]
Historia
[editar]Fue descrita por primera vez por el médico francés Louis Dühring en el año 1884,[9][1] como un cuadro clínico consistente en la presencia de lesiones polimorfas pruriginosas que denominó como dermatitis herpetiforme.[9] En 1888, Brocq describió lesiones similares diagnosticadas como “dermatitis pruriginosa polimórfica”, y después de examinar el informe de Duhring, admitió que se trataba de la misma patología. Por esta razón, actualmente se utiliza el término de “enfermedad de Dühring-Brocq” como sinónimo de la dermatitis herpetiforme.[2]
En 1940, Costello demostró la eficacia de la sulfapiridina para su tratamiento.[9]
En 1966, Marks et al. informaron de la asociación de la DH con patología intestinal.[9]
En 1967, Fry describió su relación con la intolerancia al gluten.[1] En ese mismo año, a través del estudio de inmunofluorescencia directa, Cormane describió la presencia de depósitos granulares de inmunoglobulinas a nivel de las papilas dérmicas.[9]
En 1969, van der Meer confirmó la presencia de IgA como la inmunoglobulina predominante depositada en las lesiones de la dermatitis herpetiforme,[9] lo que permitió por primera vez diferenciarla de la enfermedad bullosa lineal por IgA.[1] Actualmente está reconocida como el sello distintivo de la enfermedad.[3]
En 1973 se demostró que la dieta sin gluten estricta (DSG) produce la remisión de las lesiones cutáneas.[1]
En 1978, Strober y Katz dilucidaron la asociación genética de la enfermedad celíaca y la dermatitis herpetiforme con los antígenos de histocompatibilidad tipo HLA B8/DR3.[1]
En 1987, Kumar et al. notificaron por primera vez la presencia de anticuerpos antiendomisio en ambas enfermedades.[1]
Dieterich et al. en 1997 identificaron la transglutaminasa tisular (TGt o TG2) como el autoantígeno de la enfermedad celíaca y demostraron la presencia de anticuerpos anti-transglutaminasa tisular IgA (IgA-TGt) en el suero de pacientes con dermatitis herpetiforme.[9]
En 2002, Sárdy et al. demostraron que la transglutaminasa epidérmica (TGe o TG3) se trata del principal autoantígeno en la dermatitis herpetiforme.[9]
Actualmente, la dermatitis herpetiforme junto con la enfermedad celíaca y la ataxia por gluten, constituyen las formas autoinmunes en el consenso sobre la clasificación de los trastornos relacionados con el gluten.[3]
Epidemiología
[editar]No se han observado diferencias raciales de incidencia entre población morena o de raza negra frente a individuos de raza blanca, aunque la dermatitis herpetiforme (DH) sigue siendo una lesión cutánea predominante en poblaciones de raza blanca, más rara en poblaciones asiáticas, incluyendo japoneses y chinos.[10] En los pacientes japoneses, la dermatitis herpetiforme aparece en raras ocasiones[1] y un tercio presenta una manifestación distinta, con patrón fibrilar, sin la distribución típica de lesiones de la piel, baja asociación con la enfermedad celíaca[5] y un patrón HLA diferente.[1] La correlación entre este patrón fibrilar y la DH sigue siendo objeto de debate. Podría tratarse de una variante clínica de la DH u otro trastorno todavía no definido. Sin embargo, no existe un acuerdo unánime al respecto.[11][2]
La dermatitis herpetiforme ocurre más frecuentemente en personas con ascendencia del Norte de Europa. Es más común en Irlanda y Suecia.[5] La mayor incidencia registrada se ha documentado en Suecia, con 1 persona afectada por cada 300 habitantes.[1] Esto se puede atribuir a las asociaciones del HLA compartidas de la dermatitis herpetiforme y la enfermedad celíaca, incluyendo DQA1*0501 y DQB1*0502, que son los dos alelos que codifican los HLA-DQ2.[5]
La prevalencia global de la dermatitis herpetiforme se estima entre 10[5] y 75[12] casos por cada 100.000 habitantes.
Puede presentarse a cualquier edad. La mayoría de los casos aparece en adultos jóvenes,[1] aunque se ha diagnosticado tanto en niños de ocho meses de edad como en personas de noventa años.[2] En la edad adulta, es más frecuente en hombres que en mujeres, pero en las edades más tempranas afecta en mayor proporción a las mujeres.[1][2]
Se presenta en alrededor del 15-25% de los pacientes con enfermedad celíaca.[5]
Entre un 10-15% de familiares de primer grado de pacientes con dermatitis herpetiforme desarrolla DH o enfermedad celíaca.[9]
Etiología
[editar]La dermatitis herpetiforme (DH) es una enfermedad de la piel causada por depósitos de IgA en las papilas dérmicas,[5] que constituyen el hallazgo inmunopatológico distintivo de la DH,[7] y desencadenan una cascada inmunológica.[5] Es el resultado de una respuesta inmunológica a la estimulación persistente de la mucosa intestinal por el gluten de la dieta.[5] El factor desencadenante es la gliadina (fracción proteica del gluten). La intolerancia al gluten provoca la formación de anticuerpos frente a la gliadina en el intestino, que se depositan en la piel.[9]
El papel fundamental de la enteropatía sensible al gluten en la patogénesis de la dermatitis herpetiforme se confirma por el hecho de que la reanudación de una dieta que contiene gluten en pacientes con DH provoca una reaparición de las lesiones de la piel.[5]
La dermatitis herpetiforme y la enfermedad celíaca presentan la misma patología intestinal, una base genética común (haplotipos HLA-DQ2 y HLA-DQ8) e idéntico desencadenante ambiental: el gluten.[9]
Tanto la exposición a los rayos ultravioletas de la luz solar, como los microtraumas cutáneos repetidos, son capaces de aumentar la producción de citoquinas a nivel local, que conducen a la migración de los neutrófilos, favoreciendo los depósitos de IgA en la dermis y, por lo tanto, la aparición y mantenimiento de las lesiones cutáneas típicas de la DH.[13]
Cuadro clínico
[editar]Las lesiones primarias características de la dermatitis herpetiforme se identifican por la presencia de múltiples lesiones que pueden aparecer diseminadas o en grupos, en forma de eritema, placas de urticaria, pápulas, vesículas o ampollas. Los pacientes a menudo presentan erosiones, excoriaciones y costras, en ausencia de vesículas, que se han roto debido a la excoriación por el rascado, a causa de la picazón intensa, característicamente asociada con esta condición.[5][3]
El picor crónico y las excoriaciones producidas por el rascado, pueden conducir a su liquenificación. Además, la presencia de una zona hiperpigmentada post-inflamatoria, puede producirse cuando la lesión se resuelve o desaparece.[3][14][15][16]
La distribución más característica de las lesiones cutáneas es con predominio en las superficies extensoras de codos (90%), rodillas (30%), hombros, línea media de la espalda, nalgas y región sacra.[3] Son las localizaciones preferentes por tratarse de lugares de roce y de continuos pequeños traumas, y son también una característica muy típica de esta enfermedad. De todos modos, el cuero cabelludo, la nuca, la cara así como ambas ingles, pueden también estar afectados.[3]
Los síntomas típicos incluyen ardor, escozor y picazón intensa en las zonas afectadas. Rara vez, los pacientes se encuentran totalmente asintomáticos, aunque el grado de picor varía.[5] La comezón y la sensación de ardor, pueden predecir la aparición de nuevas lesiones. Muchos pacientes experimentan cosquilleo y comezón de intensidad variable, así como sensación de ardor, incluso antes de la aparición de lesiones en la piel.[3]
La enfermedad tiene un curso crónico, con períodos de remisión y recaída de las lesiones cutáneas.[1]
En el momento del diagnóstico de la dermatitis herpetiforme, la mayoría de los pacientes suelen estar asintomáticos a nivel digestivo, pese a la presencia de afectación intestinal.[9][5] En estos casos, la presencia de la afectación cutánea es una importante clave diagnóstica, para facilitar la detección de la enteropatía intestinal.[9]
Presentaciones atípicas
[editar]Las lesiones de la dermatitis herpetiforme (DH) también pueden aparecer a nivel de la mucosa oral y genital en los adultos.[3]
Asimismo, pueden brotar lesiones cutáneas en forma de urticaria crónica.[1]
Una manifestación de la piel poco común de la DH está representada por el desarrollo de lesiones purpúricas (petequiales). Aparecen generalmente a nivel de la superficie de las palmas de las manos[3] y/o en la planta de los pies, predominando en niños y raramente en adultos.[11][1] A veces, la presencia de lesiones petequiales en las puntas de las yemas de los dedos puede ser el principal hallazgo cutáneo de una dermatitis herpetiforme.[11]
Entre las presentaciones atípicas de la DH, se incluye también la forma denominada “queratosis palmo-plantar”, asociada o no con habones de urticaria crónica y otras lesiones que imitan la denominada “prurigo pigmentosa”.[11][1]
Diagnóstico
[editar]El diagnóstico de la dermatitis herpetiforme (DH) se suele producir con retraso, pasa frecuentemente inadvertido[9] o es mal diagnosticada,[8] siendo los pacientes sometidos a diferentes tratamientos, que resultan ineficaces y no siempre exentos de morbilidad.[9]
Se requiere un enfoque amplio, tanto clínico como histológico e inmunológico, teniendo en cuenta también las variantes atípicas de la enfermedad.[3]
Biopsias de piel
[editar]Las características histopatológicas clásicas de la dermatitis herpetiforme al microscopio incluyen la presencia de una ampolla subepitelial conteniendo neutrófilos, cuya presencia se considera el factor responsable más probable para la separación dermo-epidérmica, así como la presencia de escasos eosinófilos localizados en las puntas de las papilas dérmicas, que se acompañan de un infiltrado inflamatorio perivascular de tipo mixto. Sin embargo, en los pacientes con prurito y lesiones excoriadas, estos hallazgos histológicos no son suficientes para confirmar la DH, tal vez debido a un error en el sitio de la biopsia.[3]
Los depósitos de IgA en la dermis papilar constituyen el hallazgo inmunopatológico más característico de la DH.[7] La inmunofluorescencia directa (IFD) de las biopsias de piel no afectada, tomadas alrededor de las lesiones, está considerada como el “patrón oro” para el diagnóstico de la dermatitis herpetiforme.[8] La elección de piel de apariencia normal adyacente a las lesiones para la biopsia es fundamental, ya que a dicho nivel se encuentra una mayor concentración de IgA que en las zonas de piel afectadas o en zonas sanas, pero alejadas de las lesiones. Se describen dos patrones diferentes:[3][11]
- Depósitos granulares depositados a nivel de las papilas dérmicas.
- Depósitos granulares distribuidos difusamente a lo largo de la membrana basal.
En ambos casos, los depósitos son complejos policlonales formados por compuestos de IgA. Los dos patrones también pueden presentarse en combinación, lo que resulta en el hallazgo de IgA granular con predominio a nivel de la membrana basal, pero también con ligera acentuación a nivel de la punta de las papilas dérmicas.[17][11]
En aquellos pacientes con signos clínicos que son indicativos de DH pero con inmunofluorescencia directa negativa, una posibilidad es la confirmación de la enfermedad celíaca, lo que justifica la iniciación de una terapia específica para ambas enfermedades. Si existen dudas, algunos autores también sugieren una sobrecarga con gluten, lo que llevaría a la aparición de lesiones vesiculares durante un período de 24 horas, apoyando el diagnóstico.[1]
Afectación digestiva
[editar]Aunque todos los pacientes con DH presentan intolerancia al gluten de la dieta, la gran mayoría se encuentran asintomáticos o únicamente presentan molestias intermitentes desde el punto de vista digestivo.[1][3] No obstante, los pacientes presentan alteraciones en el examen endoscópico, que oscilan desde la denominada enteritis linfocítica o grado I (infiltración marcada de linfocitos intraepiteliales, sin atrofia de vellosidades) al grado III (atrofia de vellosidades) de la escala de Marsh.[3] Se han reportado cifras de afectación del 100%,[1][2][18] más del 90%[5] o del 60-75%.[3] Dos tercios de los pacientes presenta algún grado de atrofia en las muestras de mucosa duodenal y el tercio restante muestra un incremento de los linfocitos intraepiteliales,[5][1][15] incremento de la infiltración de linfocitos receptores de células T gamma-delta o ambos.[5]
Marcadores serológicos
[editar]Las pruebas serológicas tales como la determinación de los anticuerpos la anti-transglutaminasa en suero, son útiles para adjuntar a los datos obtenidos con el estudio de las biopsias cutáneas. Como la DH presenta grados variables de enteropatía intestinal, la correlación con las pruebas serológicas es difícil,[3] ya que su positividad guarda una relación lineal con la presencia y grado de atrofia vellositaria y por tanto pueden ser negativos dos tercios de los casos.[19]
La sensibilidad comunicada de la anti-TGt y los anti-endomisio (EMA) para la dermatitis herpetiforme ha variado (Chorzelski et al., 1986;.. Reunala et al., 1987;. Volta et al., 1992; Koop et al., 2000; Sardy et al., 2000). Estudios correlacionan la serología positiva con el daño intestinal más severo y su negativización con el seguimiento estricto de la dieta sin gluten (Volta et al., 1992) (Peters y McEvoy, 1989; Volta et al., 1992).[19]
Marcadores genéticos
[editar]La prevalencia de los marcadores genéticos HLA DQ2 y DQ8 en los pacientes con dermatitis herpetiforme (DH) es la misma que en la enfermedad celíaca (EC), apoyando el concepto de que la DH es una manifestación de la piel de la EC. Alrededor del 90% de los pacientes con DH presenta el HLA-DQ2 positivo y el resto el HLA-DQ8. Los pacientes sin alguno de estos marcadores genéticos son extremadamente raros.[3]
La dermatitis herpetiforme, como la enfermedad celíaca, presenta una clara tendencia familiar, ya que el 10-15% de los familiares de primer grado de pacientes con DH presentan EC y/o DH asociadas.[3]
Biopsias duodenales
[editar]Las biopsias de intestino delgado se consideran indicadas en los pacientes con dermatitis herpetiforme para confirmar la presencia de una enfermedad celíaca asociada. Asimismo, algunos pocos pacientes pueden desarrollar un linfoma intestinal con el tiempo, por lo que resulta importante comparar los hallazgos en las biopsias intestinales en la fase de diagnóstico y cuando se sospecha de una neoplasia.[3]
Diagnóstico diferencial
[editar]El diagnóstico diferencial se hace con la sarna, la dermatitis atópica, el eccema de contacto, el impétigo y otras enfermedades ampollosas autoinmunitarias, como la enfermedad bullosa lineal por IgA y el pénfigo.[3]
Tratamiento
[editar]El tratamiento principal consiste en la estricta eliminación del gluten de la dieta (DSG), ya que es el agente causal[9][1][5] y los fármacos se deben emplear con precaución, pues producen efectos secundarios perjudiciales acumulativos.[1]
La dapsona puede resultar una buena opción al comienzo del tratamiento para reducir la sintomatología hasta que la DSG inicia su efecto.[8][9] Su acción es bastante rápida sobre las lesiones cutáneas. No obstante, no actúa sobre la afectación intestinal, por lo que es imprescindible mantener la DSG,[9] si bien muchos pacientes con DH eligen tomar dapsona de manera crónica y no restringir la ingesta de gluten, a pesar de saber que el gluten es el agente causal de la erupción, por lo que no se recomienda esta opción.[3]
La dapsona puede provocar efectos secundarios adversos graves,[3][8] algunos potencialmente letales,[1] por lo que se debe hacer un seguimiento de los pacientes, especialmente las funciones renal y hepática. En general, el 5% de los pacientes desarrolla diversos problemas 2-6 semanas después del inicio del tratamiento.[3]
Otras opciones terapéuticas para los pacientes que no toleran la dapsona, aunque menos efectivas que esta, pueden ser las sulfonas,[6] como la sulfasalazina.[3][6]
Un estudio demostró un cierto grado de mejoría clínica de la dermatitis herpetiforme con dietas elementales y sugirió que esta mejora puede ser independiente de la ingestión de gluten;[1][5] sin embargo, no se ha confirmado este hallazgo.[5] Estas dietas consisten en aminoácidos libres, pequeñas cantidades de triglicéridos y polisacáridos de cadena corta, que son comercializados por las empresas farmacéuticas.[5]
La información al paciente incluye la necesidad del seguimiento mantenido de por vida de la dieta sin gluten, así como los efectos secundarios adversos del tratamiento con dapsona.[5]
Pronóstico
[editar]Siempre que se realice un estricto cumplimiento de la dieta sin gluten, el 85% de los pacientes son capaces de reducir la dosis de dapsona a la mitad o más, o incluso suspenderla completamente.[6] El seguimiento de la dieta es difícil y requiere motivación por parte del paciente, y la mejor respuesta ocurre cuando el gluten se elimina de manera absoluta.[5]
La supresión del gluten de la dieta durante un período de tiempo comprendido entre los 2[2] y los 10[5] años produce la desaparición de los depósitos cutáneos de IgA, que reaparecen al reintroducir el gluten en la dieta.[5] La dapsona no es capaz de reducirlos.[2]
Las complicaciones en la dermatitis herpetiforme (DH) se relacionan con la enteropatía sensible al gluten, el riesgo de desarrollar linfomas, los posibles efectos secundarios adversos de los medicamentos, en particular la dapsona,[5] y el desarrollo de trastornos autoinmunes.[6]
Los pacientes que siguen la dieta libre de gluten estricta controlan mejor los síntomas cutáneos[1] y tienen menor riesgo de desarrollar linfomas,[1][5][6][15] beneficio que generalmente se observa después de 5 años de iniciada la dieta estricta, así como la recuperación de la mucosa intestinal.[1]
En un estudio de población a 30 años realizado por Viljamaa et al., el aumento de incidencia de linfoma no se observó en los casos de DH diagnosticados más recientemente, probablemente debido a la menor importancia que se concedía a la dieta sin gluten hace 20 años.[9]
Diversas enfermedades autoinmunes son más comunes entre los pacientes con dermatitis herpetiforme (DH). La dieta sin gluten disminuye su incidencia así como el desarrollo de linfomas. Por ello, debe mantenerse de por vida, ya que las lesiones reaparecen a las pocas semanas de reintroducir el gluten.[9]
Las enfermedades autoinmunes asociadas en los pacientes con DH son, principalmente, tiroiditis autoinmune, anemia perniciosa, gastritis atrófica, diabetes mellitus tipo 1, lupus eritematoso sistémico, Síndrome de Sjögren, sarcoidosis, vitíligo, alopecia areata,[1] dermatomiositis, miastenia gravis y artritis reumatoide.[5]
Los trastornos tiroideos están presentes en al menos el 50% de los pacientes con dermatitis herpetiforme e incluyen hipo e hipertiroidismo, nódulos tiroideos y cáncer de tiroides.[5]
Seguimiento
[editar]Se requiere de seguimiento para confirmar el diagnóstico a través de la respuesta a la dieta sin gluten y también para detectar y tratar las complicaciones. Se debe evaluar a estos pacientes cada 6 meses a 1 año, con un examen clínico y consulta con un nutricionista.[1]
El seguimiento debe contemplar: el cumplimiento de la dieta sin gluten, el desarrollo de enfermedades autoinmunes relacionadas, los trastornos metabólicos (como pueden ser dislipidemia y diabetes) y la posible evolución a linfoma.[1]
El control periódico es fundamental ya que es preciso diagnosticar el linfoma tan pronto como sea posible, para dar una oportunidad de tratamiento.[3] Los pacientes no tratados con la dieta sin gluten deben ser supervisados periódicamente, para llevar a cabo una detección precoz de posible malabsorción y linfomas asociados.[14]
Teniendo en cuenta la alta incidencia de enfermedades autoinmunes y las condiciones correspondientes, los pacientes con DH deben someterse a una serie de pruebas. Ciertos anticuerpos, tales como anticuerpos anti-tiroperoxidasa o anti-TPO (positivos en el 20% de los pacientes), anticuerpos anti-células parietales gástricas (positivos en el 10-25% de los pacientes), ANA, anti-La y anti-Ro deben medirse para todos los pacientes. También deben ser realizadas pruebas adicionales controlando los niveles de TSH, T3, T4 y glucosa en ayunas.[1]
Los pacientes a tratamiento con dapsona deben ser controlados periódicamente para evaluar la presencia de efectos secundarios adversos, que pueden ser graves[3][8] y algunos potencialmente letales.[1]
Véase también
[editar]- Celiaquía
- Gluten
- Trastornos neurológicos relacionados con el gluten
- Dieta sin gluten
- Sensibilidad al gluten no celíaca
Referencias
[editar]- ↑ a b c d e f g h i j k l m n ñ o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak Clarindo, MV; Possebon, AT; Soligo, EM; Uyeda, H; Ruaro, RT; Empinotti, JC (2014 Dec). «Dermatitis herpetiformis: pathophysiology, clinical presentation, diagnosis and treatment». An Bras Dermatol 89 (6): 865-77. PMID 25387490.
- ↑ a b c d e f g h i Mendes, FB; Hissa-Elian, A; Abreu, MA; Gonçalves, VS (2013 Jul-Aug). «Review: dermatitis herpetiformis». An Bras Dermatol 88 (4): 594-9. PMID 24068131. doi:10.1590/abd1806-4841.20131775.
- ↑ a b c d e f g h i j k l m n ñ o p q r s t u v w x y z aa ab ac ad Kotze, LM (2013 Jul-Sep). «Dermatitis herpetiformis, the celiac disease of the skin!». Arq Gastroenterol 50 (3): 231-5. PMID 24322197. doi:10.1590/S0004-28032013000200041.
- ↑ Reunala T, Salmi TT, Hervonen K, Kaukinen K, Collin P (mayo de 2018). «Dermatitis Herpetiformis: A Common Extraintestinal Manifestation of Coeliac Disease». Nutrients (Revisión) 10 (5): 602. PMC 5986482. PMID 29757210. doi:10.3390/nu10050602.
- ↑ a b c d e f g h i j k l m n ñ o p q r s t u v w x y z aa ab ac arce, JM; Zaman, SAK; et al. (Updated: Jun 12, 2014). «Dermatitis Herpetiformis». Medscape.
- ↑ a b c d e f Plotnikova, N; Miller, JL (2013 Mar-Apr). «Dermatitis herpetiformis». Skin Therapy Lett 18 (3): 1-3. PMID 23674144.
- ↑ a b c Nakajima, K (2012). «Recent advances in dermatitis herpetiformis». Clin Dev Immunol 2012: 914162. PMID 22811741. doi:10.1155/2012/914162.
- ↑ a b c d e f g Caproni, M; Antiga, E; Melani, L; Murray, JA (2009). «Guidelines for the diagnosis and treatment of dermatitis herpetiformis». Jour Eur Acad Dermatol Venereol 23: 633-8. PMID 19470076. doi:10.1111/j.1468-3083.2009.03188.x.
- ↑ a b c d e f g h i j k l m n ñ o p q r s t Iranzo, P (2010). «Dermatitis herpetiforme. Patogenia, diagnóstico y tratamiento». Med Cutan Iber Lat Am 38 (1): 5-15.
- ↑ Bolotin, D; Petronic-Rosic, V (2011 Jun). «Dermatitis herpetiformis part I. Epidemiology, pathogenesis and clinical presentation». J Am Acad Dermatol 64 (6): 1017-24. PMID 21571167. doi:10.1016/j.jaad.2010.09.777.
- ↑ a b c d e f Bonciolini, V; Bonciani, D; Verdelli, A; D'Errico, A; Antiga, E; Fabbri, P; Caproni, M (2012). «Newly described clinical and immunopathological feature of dermatitis herpetiformis». Clin Dev Immunol 2012: 967974. PMID 22701503. doi:10.1155/2012/967974.
- ↑ Salmi, TT; Hervonen, K; Kautiainen, H; Collin, P; Reunala, T (2011 Aug). «Prevalence and incidence of dermatitis herpetiformis: a 40-year prospective study from Finland». Br J Dermatol 165 (2): 354-9. PMID 21517799. doi:10.1111/j.1365-2133.2011.10385.x.
- ↑ Alonso-Llamazares, J; Gibson, LE; Rogers, RS (2007 Sep). «Clinical, pathologic and immunopathologic features of dermatitis herpetiformis: review of the Mayo Clinic experience». Int Jour Dermatol 46 (9): 910-9. PMID 17822491.
- ↑ a b Kárpati, S (2012 Jan-Feb). «Dermatitis herpetiformis». Clin Dermatol 30 (1): 56-9. PMID 22137227. doi:10.1016/j.clindermatol.2011.03.010.
- ↑ a b c Ingen-Housz-Oro, S (2011 Mar). «Dermatitis herpetiformis: a review». Ann Dermatol Venereol 138 (3): 221-7. PMID 21397152. doi:10.1016/j.annder.2011.01.005.
- ↑ Cardones, AR; Hall, RP (2011 Jul). «Pathophysiology of dermatitis herpetiformis: a model for cutaneous manifestations of gastrointestinal inflammation». Dermatol Clin 29 (3): 469-77. PMID 21605814. doi:10.1016/j.det.2011.03.005.
- ↑ Nicolas, MEO; Krause, PK; Gibson, LE; Murray, JA (2003 Aug). «Dermatitis herpetiformis». Int Jour Dermatol 42 (8): 588-600. PMID 12890100.
- ↑ Fry, L (2002 Nov-Dec). «Dermatitis herpetiformis: problems, progress and prospects». Eur J Dermatol 12 (6): 523-31. PMID 12459520.
- ↑ a b Donaldson, MR; Zone, JJ; Schmidt, LA; Taylor, TB; Neuhausen, SL; Hull, CM; Meyer, LJ (2007 May). «Epidermal transglutaminase deposits in perilesional and uninvolved skin in patients with dermatitis herpetiformis». J Invest Dermatol 127 (5): 1268-71. PMID 17205060.
Enlaces externos
[editar]- Vídeo con 53 fotos de Dermatitis Herpetiforme. Voz en off: Síntomas * Diagnóstico * Diagnóstico difererencial * Tratamiento por Grupo de Trabajo Sobre Enfermedad Celíaca y Sensibilidad al Gluten No Celíaca
- Catálogo de fotos de Dermatitis Herpetiforme por Grupo de Trabajo Sobre Enfermedad Celíaca y Sensibilidad al Gluten No Celíaca