Fluoruro de estaño(II)
El fluoruro de estaño(II), es un compuesto químico con la fórmula SnF2.[1][2] Se trata de un sólido incoloro usado como ingrediente en las pastas de dientes que suelen ser más caras que las que utilizan fluoruro de sodio. El fluoruro de estaño convierte el calcio mineral apatita en fluorapatita, lo que hace al esmalte de los dientes más resistentes a los ataques con ácido de las bacterias generadas. En las pastas de dientes que contienen minerales de calcio, el fluoruro de sodio se vuelve ineficaz con el tiempo, mientras que el fluoruro de estaño sigue siendo eficaz en el fortalecimiento de esmalte de los dientes. [3] El fluoruro de estaño ha demostrado ser más eficiente que el fluoruro de sodio en la reducción de la incidencia de la caries dental [4] y en el control de la gingivitis.
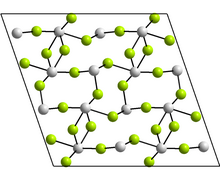
Estructura
[editar]La forma monoclínica contiene tetrámeros, Sn4F8, donde hay dos ambientes de coordinación diferentes para los átomos de Sn. En cada caso, hay tres vecinos más cercanos, con Sn en el ápice de una pirámide trigonal, y el par de electrones estéricamente activos.[3]
Preparación
[editar]Se puede preparar mediante la evaporación de una solución de SnO en 40% de HF (fluoruro de hidrógeno).
Soluciones acuosas
[editar]Es fácilmente soluble en agua, hidrolizándose. Las soluciones acuosas se oxidan fácilmente para formar precipitados insolubles de SnIV, que son ineficaces como profiláctico dental.[4][5] los estudios de la oxidación mediante la espectroscopia Mössbauer en muestras congeladas sugiere que O2 es la especie oxidante en estos procesos.
Véase también
[editar]Referencias
[editar]- ↑ «Treato results for Stannous Fluoride and Toothpaste». http://Treato.com/. Treato Ltd. Archivado desde el original el 14 de octubre de 2013. Consultado el 16 de junio de 2013.
- ↑ «Latin Names Variable Charge Metals». http://nobel.scas.bcit.ca/. British Columbia Institute of Technology Chemistry Department. Archivado desde el original el 22 de julio de 2020. Consultado el 16 de junio de 2013.
- ↑ Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- ↑ David B. Troy, 2005, Remington: The Science and Practice of Pharmacy, Lippincott Williams & Wilkins, ISBN 0-7817-4673-6, ISBN 978-0-7817-4673-1
- ↑ Denes G; Lazanas G.; Lazanas (1994). «Oxidation of SnF2 stannous fluoride in aqueous solutions». Hyperfine Interactions 90 (1): 435-439. Bibcode:1994HyInt..90..435D. doi:10.1007/BF02069152.