Fluoruro de sulfurilo
| Fluoruro de sulfurilo | ||
|---|---|---|
 | ||
 Estructura y dimensiones | ||
| Nombre IUPAC | ||
| Fluoruro de sulfurilo | ||
| General | ||
| Otros nombres | Fluoruro de sulfonilo; Difluoruro de dióxido de azufre; Difluoruro de sulfurilo; Vikane; Zythor. | |
| Fórmula estructural |
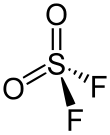 | |
| Fórmula molecular | SO2F2 | |
| Identificadores | ||
| Número CAS | 2699-79-8[1] | |
| Número RTECS | WT5075000 | |
| ChEBI | 39287 | |
| ChemSpider | 16647 | |
| PubChem | 17607 | |
| UNII | 64B59K7U6Q | |
| Propiedades físicas | ||
| Apariencia | gas incoloro | |
| Olor | inodoro[2] | |
| Densidad | 1632 kg/m³; 1,632 g/cm³ | |
| Masa molar | 101,959 g/mol | |
| Punto de fusión | 148,5 K (−125 °C) | |
| Punto de ebullición | 217,8 K (−55 °C) | |
| Presión de vapor | 15,8 atm (21 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | 0.2% (0 °C) | |
| Solubilidad | en SO2 | |
| Peligrosidad | ||
| NFPA 704 |
0
3
1
| |
| Riesgos | ||
| Riesgos principales | neurotoxina | |
| LD50 | 991 ppm (en ratas, por 4 horas)[3] | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El fluoruro de sulfurilo es un compuesto inorgánico cuya fórmula es SO2F2. Es un gas de fácil condensación y tiene propiedades más similares al hexafluoruro de azufre que al cloruro de sulfurilo, ya que es resistente a la hidrólisis incluso hasta los 150 °C.[4] Es un gas neurotóxico y de efecto invernadero pero se utiliza ampliamente como insecticida fumigante para el control de las termitas.
Estructura, preparación y reacciones
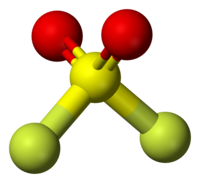
[editar]Se trata de una molécula tetraédrica con una simetría de C2v. La distancia entre S-O es de 140,5 pm y entre S-F es de 153,0 pm. Como predijo la teoría VSEPR, el ángulo O-S-O está más abierto que el ángulo F-S-F, con 124° y 97°, respectivamente.[4]
Una de las síntesis comienza con la preparación del fluorosulfito de potasio:[5]
SO2 + KF → KSO2F
A continuación, esta sal se clora para obtener el fluoruro de cloruro de sulfurilo:
KSO2F + Cl2 → SO2ClF + KCl
Al calentar de nuevo a 180 °C el fluorosulfito de potasio con el fluoruro de cloruro de sulfurilo se consigue el resultado deseado:[6]
SO2ClF + KSO2F → SO2F2 + KCl + SO2
Calentando las sales del fluorosulfonato metálico también se obtiene esta molécula:[4]
Ba(OSO2F)2 → BaSO4 + SO2F2
Se puede preparar mediante la reacción directa del flúor con el dióxido de azufre:
SO2 + F2 → SO2F2
A escala de laboratorio, el fluoruro de sulfurilo se prepara fácilmente a partir del 1,1'-sulfonildiimidazol, utilizando fluoruro de potasio y ácido.[7][8]
El fluoruro de sulfurilo no reacciona con el metal de sodio fundido.[4] Del mismo modo, su hidrólisis es lenta, pero acaba convirtiéndose en trióxido de azufre.[9][10]
El gas de fluoruro de sulfurilo es un precursor de los fluorosulfatos y los fluoruros de sulfamoilo:[11]
SO2F2 + ROH + base → ROSO2F + Hbase+F−
Uso como fumigante
[editar]Desarrollado originalmente por la empresa Dow Chemical, el fluoruro de sulfurilo se utiliza ampliamente como un insecticida fumigante para combatir a las termitas de la madera seca, sobre todo en las zonas de climas cálidos en el suroeste y sureste de Estados Unidos y en Hawai. También se utiliza con menos frecuencia para eliminar roedores, escarabajos del polvo, escarabajos del reloj de la muerte, escolitinos y chinches. Cada vez se utiliza más como sustituto del bromuro de metilo, que se retiró gradualmente por dañar la capa de ozono. Es una alternativa al uso de la fosfina, que es muy tóxica.[12]
Método de fumigación
[editar]Durante la aplicación, el espacio se cierra y se llena con el gas durante un periodo de tiempo que suele ser de al menos 16-18 horas, aunque a veces puede llegar hasta las 72 horas. Después, el espacio debe ventilarse, por lo general durante al menos 6 horas, antes de que los ocupantes puedan regresar. En California, la normativa establece que la instalación permanecerá abierta entre tres y cinco días, lo que incluye la ventilación. En EE. UU., el fluoruro de sulfurilo debe transportarse en un vehículo marcado con carteles de «Peligro de inhalación 2».[13][14] La mayoría de los estados exigen una licencia o certificación para la persona que aplica el fumigante.
La concentración se vigila constantemente y se mantiene en el nivel especificado utilizando equipos electrónicos. También se comprueban las posibles fugas con detectores electrónicos de bajo alcance. Se permite el regreso al interior cuando la concentración es igual o inferior a 5 ppm.[15] El fluoruro de sulfurilo es incoloro e inodoro, sin embargo, durante el proceso de fumigación, primero se libera en el edificio un producto de advertencia llamado cloropicrina para asegurarse de que no quedan ocupantes. La fumigación de interiores es el tratamiento más eficaz para exterminar las plagas tanto conocidas como desconocidas de los insectos que destruyen la madera. El calor es el único otro método aprobado para el tratamiento de estructuras completas contra las termitas en California.[16] El fluoruro de sulfurilo no protege contra futuras infestaciones, aunque una reinfestación importante puede tardar varios años en producirse, ya que las termitas de la madera seca tienen un crecimiento más lento que las termitas del suelo.
Peligros para la salud
[editar]La inhalación de fluoruro de sulfurilo es peligrosa y puede provocar irritación respiratoria, edema pulmonar, náuseas, dolor abdominal, depresión del sistema nervioso central, entumecimiento de las extremidades, contracciones musculares, convulsiones e incluso la muerte.[17][18][19] Las exposiciones más altas se producen cuando las personas entran de forma ilegal en las zonas fumigadas o cuando la ventilación es insuficiente. Los estudios epidemiológicos muestran que los trabajadores de fumigación que utilizaron fluoruro de sulfurilo presentaron efectos neurológicos, que incluían una reducción del rendimiento en pruebas cognitivas y pruebas de memoria de patrones, y una reducción de la capacidad olfativa.[15]
Casos reales
[editar]En 1987, una pareja de ancianos estuvo expuesta a fluoruro de sulfurilo en su casa, que ya estaba autorizada para volver a entrar.[15] Aunque la empresa de fumigación abrió las ventanas y las puertas y aireó la casa con ventiladores, no se midieron los niveles de fluoruro de sulfurilo. Tampoco se detectó cuando se tomaron muestras del aire 12 días después de haber ventilado. La pareja presentó síntomas de debilidad, náuseas y dificultad para respirar esa noche. El hombre sufrió una convulsión y murió al día siguiente. El estado de su mujer empeoró con un edema pulmonar, y murió tras una parada cardiovascular 6 días después.
En 2015, un niño de 10 años de edad tuvo daños cerebrales graves y perdió la función de su brazo y pierna izquierdos después de que su casa fuera afectada por un tratamiento con fluoruro de sulfurilo y una ventilación insuficiente, lo que dio lugar a una investigación penal por parte del Departamento de Justicia y el Departamento de Servicios Agrícolas y del Consumidor de Florida.[20] Más tarde, dos trabajadores del control de plagas se declararon culpables de los cargos por el uso indebido del pesticida que provocó el envenenamiento del niño, y fueron condenados cada uno a un año de prisión.[21]
En 2016, un hombre de 24 años que supuestamente entró en un apartamento que estaba siendo fumigado en Fremont (California) para cometer un robo se expuso al fluoruro de sulfurilo y a la cloropicrina falleciendo poco después. Según un agente de policía, experimentaba dificultades para respirar y estaba sudando antes de desplomarse a pocos pasos de la ventana del primer piso del apartamento que al parecer había robado.[22]
Gases de efecto invernadero
[editar]Basándose en las primeras mediciones atmosféricas in situ de alta frecuencia y precisión realizadas en el aire almacenado, el fluoruro de sulfurilo tiene una vida útil en la atmósfera de 30-40 años,[9] mucho más que los 5 años que se habían previsto anteriormente.[23]
Según los informes, el fluoruro de sulfurilo es un gas de efecto invernadero que es unas 4000-5000 veces más eficaz a la hora de captar la radiación infrarroja (por kg) que el dióxido de carbono (por kg).[9][24][25] La cantidad de fluoruro de sulfurilo que se libera a la atmósfera es de unas 2000 toneladas al año.[9] El principal proceso por el que se pierde el fluoruro de sulfurilo es la disolución del fluoruro de sulfurilo atmosférico en el océano, a la que sigue la hidrólisis.
Referencias
[editar]- ↑ Número CAS
- ↑ «CDC - NIOSH Pocket Guide to Chemical Hazards - Sulfuryl fluoride». www.cdc.gov. Consultado el 11 de abril de 2023.
- ↑ «CDC - Immediately Dangerous to Life or Health Concentrations (IDLH): Sulfuryl fluoride - NIOSH Publications and Products». www.cdc.gov (en inglés estadounidense). 2 de noviembre de 2018. Consultado el 11 de abril de 2023.
- ↑ a b c d Wiberg, Egon; Holleman, A. F.; Wiberg, Nils (2001). Inorganic Chemistry (en inglés). Academic Press. ISBN 978-0-12-352651-9. Consultado el 11 de abril de 2023.
- ↑ Seel, F.; Czerepinski, Ralph G.; Cady, George H. (5 de enero de 2007). Tyree, S. Y., ed. Potassium Fluorosulfite: (Potassium Fluorosulfinate). John Wiley & Sons, Inc. pp. 113-115. ISBN 978-0-470-13240-1. doi:10.1002/9780470132401.ch29. Consultado el 11 de abril de 2023.
- ↑ Seel, F.; Duncan, Leonard C.; Czerepinski, Ralph G.; Cady, George H. (5 de enero de 2007). Tyree, S. Y., ed. Sulfuryl Chloride Fluoride and Sulfuryl Fluoride. John Wiley & Sons, Inc. pp. 111-113. ISBN 978-0-470-13240-1. doi:10.1002/9780470132401.ch28. Consultado el 11 de abril de 2023.
- ↑ Veryser, Cedrick; Demaerel, Joachim; Bieliu̅nas, Vidmantas; Gilles, Philippe; De Borggraeve, Wim M. (6 de octubre de 2017). «Ex Situ Generation of Sulfuryl Fluoride for the Synthesis of Aryl Fluorosulfates». Organic Letters (en inglés) 19 (19): 5244-5247. ISSN 1523-7060. doi:10.1021/acs.orglett.7b02522. Consultado el 11 de abril de 2023.
- ↑ Gurjar, Jitendra; Bater, Jorick; Fokin, Valery V. (6 de febrero de 2019). «Sulfuryl Fluoride Mediated Conversion of Aldehydes to Nitriles». Chemistry – A European Journal (en inglés) 25 (8): 1906-1909. ISSN 0947-6539. doi:10.1002/chem.201805175. Consultado el 11 de abril de 2023.
- ↑ a b c d Mühle, J.; Huang, J.; Weiss, R. F.; Prinn, R. G.; Miller, B. R.; Salameh, P. K.; Harth, C. M.; Fraser, P. J. et al. (12 de marzo de 2009). «Sulfuryl fluoride in the global atmosphere». Journal of Geophysical Research (en inglés) 114 (D5): D05306. ISSN 0148-0227. doi:10.1029/2008JD011162. Consultado el 11 de abril de 2023.
- ↑ Cady, George H.; Misra, Sudhindra. (1 de abril de 1974). «Hydrolysis of sulfuryl fluoride». Inorganic Chemistry (en inglés) 13 (4): 837-841. ISSN 0020-1669. doi:10.1021/ic50134a016. Consultado el 11 de abril de 2023.
- ↑ Dong, Jiajia; Krasnova, Larissa; Finn, M. G.; Sharpless, K. Barry (1 de septiembre de 2014). «Sulfur(VI) Fluoride Exchange (SuFEx): Another Good Reaction for Click Chemistry». Angewandte Chemie International Edition (en inglés) 53 (36): 9430-9448. doi:10.1002/anie.201309399. Consultado el 11 de abril de 2023.
- ↑ Bell, C. H (12 de septiembre de 2000). «Fumigation in the 21st century». Crop Protection. XIVth International Plant Protection Congress (en inglés) 19 (8): 563-569. ISSN 0261-2194. doi:10.1016/S0261-2194(00)00073-9. Consultado el 11 de abril de 2023.
- ↑ «HAZARDOUS MATERIALS TABLE, SPECIAL PROVISIONS, HAZARDOUS MATERIALS COMMUNICATIONS, EMERGENCY RESPONSE INFORMATION, AND TRAINING REQUIREMENTS». www.govinfo.gov. Consultado el 11 de abril de 2023.
- ↑ «49 CFR § 172.540 - POISON GAS placard.». LII / Legal Information Institute (en inglés). Consultado el 11 de abril de 2023.
- ↑ a b c «Sulfuryl Fluoride (Vikane) Risk Characterization Document Volume I Health Risk Assessment». Portal del Estado de California (California State Portal).
- ↑ «Termites Fact Sheet». STRUCTURAL PEST CONTROL FACT SHEET (DEPARTMENT OF CALIFORNIA).
- ↑ Schneir, Aaron; Clark, Richard F.; Kene, Mamta; Betten, David (1 de enero de 2008). «Systemic fluoride poisoning and death from inhalational exposure to sulfuryl fluoride». Clinical Toxicology 46 (9): 850-854. ISSN 1556-3650. doi:10.1080/15563650801938662. Consultado el 11 de abril de 2023.
- ↑ Centers for Disease Control (CDC) (18 de septiembre de 1987). «Fatalities resulting from sulfuryl fluoride exposure after home fumigation--Virginia». MMWR. Morbidity and mortality weekly report 36 (36): 602-604, 609-611. ISSN 0149-2195. PMID 3114607. Consultado el 11 de abril de 2023.
- ↑ Scheuerman, E. H. (1 de julio de 1986). «Suicide by Exposure to Sulfuryl Fluoride». Journal of Forensic Sciences (en inglés estadounidense) 31 (3): 1154-1158. ISSN 0022-1198. doi:10.1520/JFS11128J. Consultado el 11 de abril de 2023.
- ↑ Ganim, Sara (4 de septiembre de 2015). «10-year-old hospitalized after termite fumigation». CNN (en inglés). Consultado el 11 de abril de 2023.
- ↑ «Fumigators sentenced in child's poisoning». WPTV News Channel 5 West Palm (en inglés). 11 de mayo de 2016. Consultado el 11 de abril de 2023.
- ↑ «Fremont Burglary Suspect Who Entered Fumigated Home Dies». www.cbsnews.com (en inglés estadounidense). Consultado el 11 de abril de 2023.
- ↑ «Directive 98/8/EC concerning the placing biocidal products on the market Inclusion of active substances in Annex I to Directive 98/8/EC Assessment Report SULFURYL FLUORIDE PT8». Agencia Europea de Sustancias y Mezclas Químicas.
- ↑ Papadimitriou, Vassileios C.; Portmann, R. W.; Fahey, David W.; Mühle, Jens; Weiss, Ray F.; Burkholder, James B. (11 de diciembre de 2008). «Experimental and Theoretical Study of the Atmospheric Chemistry and Global Warming Potential of SO 2 F 2». The Journal of Physical Chemistry A (en inglés) 112 (49): 12657-12666. ISSN 1089-5639. doi:10.1021/jp806368u. Consultado el 11 de abril de 2023.
- ↑ Sulbaek Andersen, M. P.; Blake, D. R.; Rowland, F. S.; Hurley, M. D.; Wallington, T. J. (15 de febrero de 2009). «Atmospheric Chemistry of Sulfuryl Fluoride: Reaction with OH Radicals, Cl Atoms and O 3 , Atmospheric Lifetime, IR Spectrum, and Global Warming Potential». Environmental Science & Technology (en inglés) 43 (4): 1067-1070. ISSN 0013-936X. doi:10.1021/es802439f. Consultado el 11 de abril de 2023.
Enlaces externos
[editar]- Esta obra contiene una traducción parcial derivada de «Sulfuryl fluoride» de Wikipedia en inglés, concretamente de esta versión del 25 de noviembre de 2022, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
