Geometría molecular en forma de T
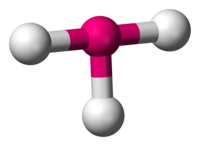
En química, la geometría molecular en forma de T, describe la estructura adoptada por algunos compuestos en los que un átomo central tiene tres ligandos. Por lo general, los compuestos de coordinación con un átomo central y tres sustituyentes adoptan geometrías trigonales planas o piramidales. Ejemplos de moléculas en forma de T son los trifluoruros de halógeno, por ejemplo, ClF3.[1]
De acuerdo con la teoría RPECV la geometría en forma de T se da en moléculas de tipo AX3E2 con tres ligandos y dos pares de electrones no enlazantes sobre un átomo central. Los tres átomos exteriores se enlazan al átomo central, formando ángulos de 90° entre sí, produciendo la forma de T.[2] De acuerdo con la teoría del enlace de valencia, las moléculas en forma de T poseen hibridación sp3d.[3]
Generalmente se acepta que el orbital d no contribuye a la unión de estas moléculas, que pueden ser descritas de modo más simple mediante la teoría de orbitales moleculares.
Véase también
[editar]Enlaces externos
[editar]- Chem Química, estructuras, y moléculas en 3D (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- Centro de estructura molecular de la Universidad de Indiana
- Simetrías de grupo puntual. Ejemplos interactivos.
- Modelado molecular
- Visualización de estructura plana trigonal animada
Referencias
[editar]- ↑ Greenwood, N. N.; & Earnsh.ç,llpaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ↑ "Chemistry Dictionary and Glossary." 2005. http://www.ktf-split.hr/glossary/no_en_o.php?def=T-shaped%20molecular%20shape Archivado el 21 de julio de 2011 en Wayback Machine.
- ↑ Cap. 6: Estructura molecular y Estereoquímica: especies covalentes sencillas. En: Química inorgánica: texto superior para uso de los estudiantes de las facultades de ciencias y escuelas de ingeniería. Therald Moeller. Editorial Reverté, 1994. ISBN 8429173900. Pág. 295