Lípido de membrana

Los lípidos constituyen aproximadamente el 50 % de las moléculas de las membranas biológicas, en la mayoría de las células. Sin embargo, en las membranas mitocondriales, esta proporción puede rebajarse hasta solo un 15% de la masa total de la membrana. Los lípidos se pueden juntar de distintos modos para formar una membrana: en micelas, en bicapas lipídicas o bien en liposomas, pero las membranas plasmáticas son siempre bicapas (con excepción de la "monocapa" presente en algunas de las arqueas, que son bastante más estables y resistentes a la disgregación, por lo tanto, no resulta extraño que este tipo de membrana sea habitual entre las arqueas hipertermófilas, que se desarrollan en ambientes con temperaturas muy altas).
Estas mismas, son las que permite que accedan distintos tipos de sustancias, lo que tienen que cumplir con la característica.
Características principales
[editar]Función y estructura básica
[editar]La función principal de los lípidos en las membranas biológicas es estructural. En efecto, son los lípidos quienes dan soporte a las membranas, componentes esenciales de toda célula, ya que permiten formar diferentes compartimentos celulares en las células eucariotas, además de ser quienes marcan la frontera entre las células y el mundo extracelular (gracias a la membrana plasmática). Por otra parte, los lípidos actúan como barrera al flujo de moléculas grandes o polares.
La mayoría de las membranas están formadas por bicapas de un grosor de entre 6 y 10 nm.[1] En una porción de una membrana animal de 1 μm x 1 μm se encuentran 5 millones de moléculas lipídicas, por lo que en una membrana animal de una célula pequeña se suelen encontrar mil millones de moléculas lipídicas.[2]
Todas las células constan de membranas plasmáticas formadas por bicapas lipídicas. A raíz de los efectos de las interacciones hidrofóbicas por parte de los lípidos (al ser apolares, no interactúan con las moléculas de agua), las moléculas lipídicas se juntan de forma espontánea y los lípidos forman un agregado, en modo de micelas de diámetro de 10-20 nm que constituyen vesículas[3] cuando los lípidos tienen forma de cuña (ácidos grasos) y en forma de bicapas cuando las moléculas son cilíndricas (fosfolípidos). Todos los lípidos de membrana tienen unas cabezas hidrofílicas (siente atracción por el agua) que están en contacto con el agua y unas colas hidrofóbicas (apolar) que quedan escondidas en el agregado. Todas las interacciones entre lípidos para formar membranas son no covalentes.
Casi todos los lípidos de membranas son pues anfipáticos, exceptuando unos muy pocos ácidos neutros. Esta condición, además de conferirles a los lípidos la posibilidad de formar bicapas o micelas, está al origen de las propiedades de autosellado. Estas propiedades permiten a las bicapas cerrarse espontáneamente, ya que no pueden existir extremos libres en las bicapas y consecuentemente se cierran sobre sí mismas.[2] Este sellado es energéticamente favorable y permitió el aparecer de la vida, ya que una célula necesita tener unas fronteras para ser viable y para ser caracterizada como tal.
Movilidad y fluidez
[editar]La característica principal de los lípidos de membrana es que tienen una alta fluidez que les permite mucho movimiento, contrariamente a lo que se pensaba hasta 1972, momento en el cual Jonathan Singer y Garth Nicolson propusieron el modelo del mosaico fluido.
La fluidez de las membranas causada por los lípidos permite la permeabilidad selectiva de las moléculas que atraviesan la membrana, además de ser imprescindible en algunos procesos metabólicos, cómo es el caso del movimiento del coenzima Q en la membrana mitocondrial, en procesos de transporte o en la transducción de señales.[3]
Los lípidos tienen varias formas de movimiento: pueden moverse lateralmente, en el plano de la membrana, pueden rotar sobre sí, pueden tener movimientos de flexión en los cuales son las cadenas las que se mueven, y finalmente pueden padecer procesos de flip-flop.[2]
Tipos de movimiento
[editar]- Difusión lateral: es el movimiento más común en los lípidos de membrana y es de una velocidad alta. En efecto, su coeficiente de difusión es de 10-8 cm2/s.[2] Es decir que se difunde en toda la longitud de la membrana en unos pocos segundos.
- Rotación y flexión: son fenómenos observados pero de los cuales se sabe poco. Se podría pensar que es para facilitar en algunos casos la entrada de las moléculas en la célula y aumentar así la permeabilidad.[2]
- Flip-flop: permite el traspaso de los lípidos de una capa a la otra de la bicapa. Es un proceso muy lento y que consume mucha energía, ya que las cabezas polares de los fosfoglicéridos deben atravesar un medio apolar. Aun así, es imprescindible, para que se regenere la monocapa no citosólica. Por ello, los lípidos cuentan con la ayuda de unas enzimas que facilitan el movimiento: las flipasas o translocadoras de fosfolípidos. Estas enzimas se encuentran en el Retículo Endoplasmático, dónde se sintetizan los lípidos, y en la membrana plasmática. El movimiento de flip-flop es raro y ocurre solo una vez por día.[3]
Regulación de la fluidez
[editar]La fluidez de las bicapas lipídicas está controlada por varios factores. Esta regulación debe ser precisa para que no se detengan los procesos de transporte o enzimáticos, ya que se pueden detener si la viscosidad aumenta o baja más allá de un nivel límite. Por ello algunos mecanismos permiten controlar la fluidez. La composición de la membrana y la temperatura son los elementos que más interfieren en la viscosidad de la membrana.
Estructura de los fosfolípidos
[editar]La fluidez de las membranas depende sobre todo de la longitud y del nivel de insaturación de los fosfolípidos. En efecto, cuánto más cortos y más insaturados son los lípidos de membrana, más fluida es esta última. Este hecho se debe a que las cadenas largas muestran una mayor asociación entre sí. Concretamente, por cada grupo -CH2- añadido, la energía libre de interacción entre dos cadenas disminuye en 0, 5 kcal mol-1, por lo que la interacción es más fuerte.[1] Cuando las cadenas son más cortas, se reduce pues la interacción entre los grupos alquilos de los lípidos. Por otro lado, el grado de saturación de los fosfolípidos también infiere en la fluidez. Las membranas con lípidos poco insaturados son muy rígidas, ya que las cadenas hidrocarbonadas interaccionan fuertemente entre ellas. Del mismo modo, los dobles enlaces rebajan el empaquetamiento de los lípidos gracias a su “doblez”.
Temperatura
[editar]La fluidez de una membrana también depende de la temperatura del medio. Una bicapa puede pasar de estar en forma líquida y viscosa a una forma más ordenada y cristalina, perdiendo pues sus propiedades de movimiento. Este cambio de estado se conoce por transición de fase. Una membrana entra en transición de fase cuando la temperatura supera la temperatura de transición. Más allá de una cierta temperatura, que depende de la longitud y del grado de insaturación de las cadenas de los fosfolípidos, la membrana se fusiona. Por lo tanto, si las colas son cortas e insaturadas, esta temperatura será más baja y será más difícil cristalizar la membrana. Este hecho se observa en las patas de los animales polares, que tienen membranas muy insaturadas para que no se congelen. Por otro lado, algunas bacterias cómo la E.Coli modifican la proporción de lípidos saturados e insaturados en función del cambio de temperatura.[4]
Colesterol
[editar]Otro elemento que controla la fluidez de las membranas es la proporción de colesterol. La correlación entre los niveles de colesterol y la fluidez de la membrana es complejo. El anillo esteroide rigidiza la membrana en la región comprendida desde el comienzo de las cadenas carbonadas hasta el carbono 9 de los fosfolípidos. A partir de allí, el segmento isooctilo imposibilita una fuerte interacción entre las cadenas carbonadas de los fosfolípidos, aumentando notablemente la fluidez.[5] Esto resulta especialmente relevante a bajas temperaturas, situación en que la fluidez general de la membrana se ve reducida. En este sentido el colesterol resulta un inhibidor, al mismo modo que las insaturaciones, de las transiciones de fase hacia la cristalización. De esta manera, dependiendo de las circunstancias y a región de la bicapa considerada, el colesterol puede aportar tanto a la rigidez como a la fluidez de la membrana plasmática.
Asimetría de los lípidos de membrana
[editar]Otra característica importante de los lípidos de membrana es que presentan una fuerte asimetría. Existen dos tipos de asimetría: una en la proporción de fosfolípidos entre una capa y otra de la bicapa lipídica y otra entre diferentes regiones de la membrana.
Esta asimetría responde a una funcionalidad y a la biosíntesis de cada tipo de lípido.
Asimetría entre monocapas
[editar]La asimetría entre capas puede ser absoluta, cómo en el caso de los glucolípidos, que siempre se sitúan en la monocapa no citosólica, o no absoluta, como es el caso de los fosfolípidos. La mayoría de los fosfolípidos cargados negativamente se sitúan en la cara interior (fosfatidilserina y fosfatidiletanolamina) mientras que los fosfolípidos cargados positivamente como la fosfatidilcolina y la esfingomielina se encuentran en la cara exterior. Este desajuste es una de las causas del potencial de membrana que se observa en las membranas celulares.[4]
La asimetría de las membranas también contribuye a la señalización celular. Cada fosfolípido tiene su tarea y su posición es adecuada para realizar la función que le caracteriza. La asimetría se produce en varias etapas: el retículo endoplasmático liso origina los lípidos de las membranas asimétricas. Los hidratos de carbono sintetizados siempre acaban en la cara citosólica del retículo, aunque se formen en la cara luminal. Luego, cuando se añaden los grupos fosfato, los fosfolípidos, gracias a la acción de flipasas, van a la cara luminal o se quedan en la citosólica. Los lípidos que acaban en la cara citosólica de las vesículas se quedan en la monocapa citosólica, de preferencia, mientras que los de la cara luminal se quedan en la monocapa extracelular. Sin embargo, gracias a las flipasas, estas localizaciones son dinámicas y pueden ir cambiando.[3]
La otra asimetría que se puede vislumbrar en las membranas es la diferencia de componentes por regiones de membrana. En efecto, la membrana plasmática contiene microdominios enriquecidos en algún lípido como pueden ser esfingolípidos o colesterol. Algunos lípidos se concentran pues en algunas zonas. Esta aglomeración se debe al gran tamaño de algunos esfingolípidos, que mantienen una fuerte interacción entre ellos, lo que crea unas zonas más gruesas que otras en la membrana plasmática. Estos conglomerados, llamados lipid rafts, son de gran ayuda para la transducción de señales por parte de proteínas receptoras.
Los lípidos de membrana confieren pues a la membrana plasmática un alto dinamismo, mediante su movilidad, su fluidez y su asimetría.
Tipos de lípidos en las membranas
[editar]En las membranas biológicas hay gran variedad de lípidos, pero se pueden clasificar en cuatro grandes grupos.
Fosfolípidos
[editar]Los fosfolípidos son las moléculas más abundantes en las membranas biológicas. Aunque se pueden clasificar en dos grupos distintos, llevan todos un único grupo fosfato unido a un aminoalcohol que les caracteriza. Los fosfolípidos se encuentran en ambas caras de la membrana citoplasmática. Empresas como Lipoid, Avanti Polar o VAV Life Sciences[6] producen comercialmente fosfolípidos purificados, para los cuales se han encontrado aplicaciones en la nanotecnología y la ciencia de los materiales.

Los glicerofosfolípidos muestran dos ácidos grasos esterificados con una molécula de glicerol y un ácido fosfatídico -compuesto por un grupo fosfato y un grupo aminoalcohol- unido al glicerol. Es el resto aminoalcohol quién caracteriza y determina los diferentes fosfoglicéridos.
Los fosfoglicéridos se originan a partir de la biosíntesis del fosfatidato, gracias a la doble aportación en cadenas de ácidos grasos por parte de dos Acil coenzima A. Luego se añaden restos aminoalcoholes a la molécula mediante enlaces éster con el grupo fosfato. Todos los glicerofosfolípidos tienen una cabeza muy polar que siempre lleva alguna carga, lo que les confiere propiedades interesantes para la señalización.[7]
Los glicerofosfolípidos más corrientes son la fosfatidilserina, la fosfatidiletanolamina, la fosfatidilcolina y el fosfatidilinositol. Los dos primeros se encuentran básicamente en la cara interna de la membrana, por el hecho de que contienen un grupo amino primario terminal. La fosfatidilcolina, en cambio, se encuentra más bien en la cara externa. La fosfatidilserina, la fosfatidiletanolamina, la fosfatidilcolina y la esfingomielina (esfingolípido) constituyen más de la mitad del peso lipídico de las membranas biológicas.[2]
Estos fosfolípidos tienen funciones específicas en la señalización celular, por lo que sus localizaciones dependen de la función que desarrollan. La fosfatidilserina es pues imprescindible para la proteína quinasa C (PKC). En efecto, esta proteína necesita estar cerca de este fosfolípidos y que este esté cargado negativamente para ser funcional. Por otro lado, el fosfatidilinositol, localizado en la cara citosólica, es muy importante en algunos procesos como el anclaje de proteínas, aunque se encuentre en proporciones bajas. Mediante modificaciones sobre este lípido, se puede fomentar el reclutamiento de proteínas citosólicas en alguna región concreta de la membrana.[2]

Además, estos fosfolípidos son imprescindibles para la señalización celular, ya que al recibir alguna señal del medio extracelular, las fosfolipasas cortan fragmentos de fosfoglicéridos, que actúan entonces como señales en la célula misma.[2]
El hecho de que exista esta variedad consecuente de fosfolípidos se debe a estos procesos específicos. En efecto, los fosfolípidos actúan cómo disolvente específico de proteínas. Algunas proteínas requieren unas cabezas polares determinadas para ser funcionales. Por lo tanto, la diversidad de proteínas de la membrana proporciona una posible explicación a la diversidad de fosfolípidos.[2]
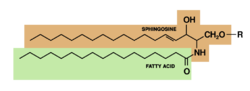
Los esfingofosfolípidos se caracterizan por tener una molécula de esfingosina como base, en vez de una molécula de glicerol. A ella se liga un ácido graso mediante un enlace amida. Esta unión produce una molécula llamada cerámida. La biosíntesis de la cerámida se debe a la unión del Palmitoïl-Coenzima-A con la Serina; unión que sufre reducciones para convertirse en ceramida. A la ceramida se añade un componente aminoalcohol mediante una esterificación. Los esfingofosfolípidos también muestran una cabeza polar.

El esfingolípido más habitual en las membranas es la esfingomielina, que se encuentra en las vainas de mielina. Se sintetiza gracias a la unión de un resto de fosfocolina a la cerámida. El prefijo esfingo- proviene de la naturaleza enigmática (cómo la esfinge) del papel de estos lípidos. Se sabe que pueden actuar como segundos mensajeros y que la cerámida de los esfingolípidos puede iniciar la apoptosis celular.

Los glicolípidos, también llamados esfingoglicolípidos, son lípidos sintetizados a partir de una molécula de cerámida a quien se ha añadido un glúcido.
Las adiciones de los grupos azúcares tienen lugar en el lumen del aparato de Golgi.
Los glicolípidos forman parte únicamente de la capa exterior de la membrana celular. Constituyen aproximadamente el 5% de las moléculas lipídicas de la membrana, pero su papel es importante en tareas de protección, ya que forman un glicocáliz que protege la célula y que proporciona las bases moleculares del sistema de grupos sanguíneos. En las células epiteliales, el glicocáliz es imprescindible para mantener un nivel fisiológico del pH intracelular. Por otro lado, los glicolípidos están implicados en procesos de reconocimiento celular e interaccionan con el medio extracelular.[2]
Los glicolípidos se dividen en dos grupos.
Cerebrósidos
[editar]Los cerebrósidos son glicolípidos que solo contienen un resto de azúcar, que puede ser glucosa o galactosa. Son lípidos abundantes en las membranas del sistema nervioso, y no están cargados ya que no tienen grupo fosfato.
Gangliósidos
[editar]Los gangliósidos están formados por varios restos de azúcar. Siempre llevan uno o más residuos de ácido siálico (NANA), que les proporcionan una carga negativa. Existen muchos tipos diferentes de gangliósidos, ya que la cantidad y la diversidad de restos de glúcidos determinan diferentes lípidos.
Los gangliósidos se encuentran sobre todo en las membranas plasmáticas de las células nerviosas del cerebro, dónde pueden llegar a constituir hasta un 10% de la masa lipídica.[2]
Además de servir en las etapas iniciales de la señalización, son fundamentales para que las células del sistema inmunitario se unan a los lugares de destrozo dentro del proceso de la respuesta inflamatoria.[7] Por otro lado, al estar cargados, influyen también en el campo eléctrico de la membrana y algunos estudios muestran que también infiere en la concentración de iones Ca2+.[2]

El colesterol es un esteroide formado por la unión de cuatro anillos hidrocarbonados a quienes se han unido en un extremo una cola hidrocarbonada y en el otro un grupo hidroxilo. Es pues, a su vez, un lípido anfipolar.
El colesterol está presente en ambas capas de la membrana que recubre a la célula. Interacciona con las cabezas polares de los fosfolípidos mediante su cola hidroxila, mientras interactúa con las cadenas de ácidos grasos mediante sus anillos y su cola hidrocarbonada.
El colesterol está muy presente en las membranas de las células nerviosas (alrededor de un 25%) de los animales, pero no se encuentra en los procariotas y en algunos compartimentos intracelulares.
La biosíntesis del colesterol, muy regulada a niveles de los enzimas y de la transcripción de genes por inhibiciones y por la velocidad de entrada del colesterol en la sangre, se hace en tres etapas en las cuales es el Acetil-coenzimaA quien proporciona los 27 átomos de carbono.
El colesterol, por su estructura en “silla”, es más voluminoso y altera la organización regulada de la membrana. Por otro lado, suele esterificarse el residuo hidroxilo con las cadenas hidrofóbicas de los lípidos.
Como hemos visto anteriormente, el colesterol es imprescindible en la regulación de la fluidez de la membrana, ya que los anillos esteroideos, planos y rígidos, inmovilizan los primeros residuos – CH2- de las cadenas hidrocarbonadas.

Los glicoglicerolípidos son lípidos compuestos por una molécula de glicerol unida a dos ácidos grasos y un resto azúcar por esterificaciones. Se parecen a los cerebrósidos, pero en vez de estar unido a una cerámida, el azúcar está unido a un glicerol.[9]
Estos lípidos son poco comunes en las membranas animales, pero están muy presentes en las membranas vegetales. Por ejemplo, llegan a constituir el 50% de los lípidos de las membranas de los cloroplastos.
Véase también
[editar]Referencias
[editar]- ↑ a b Bioquímica, capítulo 12, Lípidos y membranas celulares, Jeremy M. Berg, John L Tymozcko y Lubert Stryer
- ↑ a b c d e f g h i j k l m Biología Molecular de la Célula, Parte IV, Capítulo 10, Bruce Alberts
- ↑ a b c d Bioquímica, Parte IV, Capítulo 24, Estructura y dinámica de las membranas biológicas, Werner Müller-Esterl
- ↑ a b c Bioquímica, Parte II, Capitúlo 10, Lípidos, membranas y transporte celular, Mathews, Van Holde y Ahern
- ↑ Subczynski et al. High Cholesterol/Low Cholesterol: Effects in Biological Membranes Review. Cell Biochem Biophys. 2017 Dec;75(3-4):369-385. DOI 10.1007/s12013-017-0792-7
- ↑ «VAV Life Sciences launches India’s first phospholipid manufacturing plant» (en inglés). Indian Express. Archivado desde el original el 27 de mayo de 2019. Consultado el 31 Jaunary 2017.
- ↑ a b c Bioquímica, capítulo 26, Biosíntesis de lípidos de membrana y de esteroides, Jeremy M. Berg, John L Tymozcko y Lubert Stryer
- ↑ Biosíntesis de lípidos de membrana y de esteroides, Jeremy M. Berg, John L Tymozcko y Lubert Stryer
- ↑ [1] biomoleculas