Molnupiravir
| Molnupiravir | ||
|---|---|---|
| General | ||
| Fórmula estructural |
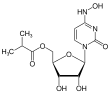 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 2349386-89-4[1] | |
| ChEBI | 180653 | |
| ChemSpider | 84400552 | |
| DrugBank | DB15661 | |
| PubChem | 145996610 | |
| UNII | YA84KI1VEW | |
| Propiedades físicas | ||
| Masa molar | 329,122299948 g/mol | |
El molnupiravir (códigos de desarrollo MK-4482 y EIDD-2801) es un medicamento antiviral experimental de ingesta oral desarrollado originalmente para el tratamiento de la gripe. Es un profármaco derivado del nucleósido sintético N4-hidroxicitidina que ejerce su acción antiviral a través de la introducción de errores de copia durante la replicación viral de ARN.[2][3] También se ha demostrado su actividad contra algunos coronavirus, como el SARS, el MERS y el SARS-CoV-2.[4]
El fármaco fue desarrollado en la Universidad Emory, concretamente por la Compañía de Innovación Farmacológica de Emory (DRIVE, por sus siglas en inglés). Luego fue adquirido por Ridgeback Biotherapeutics, una compañía con sede en Miami que más tarde se asociaría con Merck & Co (que fuera de Estados Unidos y Canadá es conocida como MSD) para continuar desarrollando el fármaco.
Controversia de seguridad
[editar]En abril de 2020, el antiguo Jefe de la Autoridad Estadounidense de Desarrollo e Investigación Biomédica Avanzada hizo públicas sus preocupaciones acerca de la financiación del desarrollo de molnupiravir, debido al hecho de que algunos fármacos similares habían demostrado tener propiedades mutágenas al producir defectos de nacimiento.[5] Anteriormente Pharmasset, otra compañía que había investigado el ingrediente activo del medicamento, lo abandonó. George Pintor, CEO de DRIVE, negó estas afirmaciones mencionando que los datos obtenidos a partir de diferentes estudios de toxicidad con el molnupiravir habían sido proporcionados a reguladores de los Estados Unidos y del Reino Unido, países que en la primavera de 2020 permitieron que los estudios de seguridad en humanos siguieran adelante. También en este momento, DRIVE y Ridgeback Biotherapeutics declararon que habían planeado futuros estudios en animales.[6]
COVID-19
[editar]Tras descubrirse su efectividad contra el SARS-CoV-2 en marzo de 2020, la "seguridad, tolerancia y farmacocinética" del molnupiravir fueron probadas en un estudio preliminar con voluntarios sanos del Reino Unido y de los EE. UU.[7] En junio de 2020, Ridgeback Biotherapeutics anunció el avance hacia las pruebas de la fase II, cuyo objetivo sería el de probar la eficacia del fármaco como tratamiento contra el COVID-19.[8] En julio, dos pruebas con pequeñas cantidades de pacientes hospitalizados y no hospitalizados de los EE. UU. y el Reino Unido estaban ya en curso.[9][10] A finales de dicho mes y sin haber publicado dato médico alguno, Merck, quien había estado asociado con Ridgeback Biotherapeutics en el desarrollo del fármaco, anunció su intención de llevar al molnupiravir a las etapas finales de los experimentos en septiembre de 2020.[11] Así, el 19 de octubre de 2020, Merck comenzó una nueva etapa de un año en la que 2/3 de las pruebas estarían centradas en pacientes hospitalizados.[12]
El 3 de diciembre de 2020, la revista Nature publicó un artículo sobre los resultados de un estudio en el tratamiento con molnupiravir de hurones infectados con Covid-19.[13] El estudio halló que el fármaco administrado por vía oral era "eficaz" en dichos animales.
En noviembre de 2021, un estudio basado en 1408 sujetos, mostró que Molnupiravir redujo el riesgo de hospitalización o muerte en personas con COVID-19 que tenían un mayor riesgo de enfermedad grave del 9,7% en el grupo de placebo al 6,8% en el grupo de Molnupiravir, siendo aprobado su uso en Italia dos meses más tarde.[14][15]
Referencias
[editar]- ↑ Número CAS
- ↑ «Characterization of orally efficacious influenza drug with high resistance barrier in ferrets and human airway epithelia». Science Translational Medicine 11 (515): eaax5866. October 2019. PMC 6848974. PMID 31645453. doi:10.1126/scitranslmed.aax5866.
- ↑ «Quantitative efficacy paradigms of the influenza clinical drug candidate EIDD-2801 in the ferret model». Translational Research 218: 16-28. April 2020. PMID 31945316. doi:10.1016/j.trsl.2019.12.002.
- ↑ «An orally bioavailable broad-spectrum antiviral inhibits SARS-CoV-2 in human airway epithelial cell cultures and multiple coronaviruses in mice». Science Translational Medicine 12 (541): eabb5883. April 2020. PMC 7164393. PMID 32253226. doi:10.1126/scitranslmed.abb5883.
- ↑ Halford, Bethany. «An emerging antiviral takes aim at COVID-19». Consultado el 1 de agosto de 2020.
- ↑ Cohen, Jon (13 de mayo de 2020). «Emails offer look into whistleblower charges of cronyism behind potential COVID-19 drug». Science. Consultado el 1 de agosto de 2020.
- ↑ «COVID-19 First In Human Study to Evaluate Safety, Tolerability, and Pharmacokinetics of EIDD-2801 in Healthy Volunteers». ClinicalTrials.gov. Consultado el 1 de junio de 2020.
- ↑ «Ridgeback Biotherapeutics Announces Launch of Phase 2 Trials Testing EIDD-2801 as Potential Treatment for COVID-19». Business Wire. Consultado el 4 de julio de 2020.
- ↑ «A Safety, Tolerability and Efficacy of EIDD-2801 to Eliminate Infectious Virus Detection in Persons With COVID-19». ClinicalTrials.gov. Consultado el 4 de julio de 2020.
- ↑ «The Effect of EIDD-2801 on Viral Shedding of SARS-CoV-2 (COVID-19)». ClinicalTrials.gov. Consultado el 4 de julio de 2020.
- ↑ Court, Emma (31 de julio de 2020). «Merck pushes ahead on COVID-19 treatment, vaccines». Consultado el 31 de julio de 2020.
- ↑ ClinicaL trials register : Efficacy and Safety of Molnupiravir (MK-4482) in Hospitalized Adult Participants With COVID-19 (MK-4482-001)
- ↑ Therapeutically administered ribonucleoside analogue MK-4482/EIDD-2801 blocks SARS-CoV-2 transmission in ferrets
- ↑ EMA reviewing new data on effectiveness of molnupiravir for the treatment of COVID-19
- ↑ Llega a Italia el molnupiravir, la píldora de Merck contra la COVID-19