Monocapa autoensamblada
Las monocapas autoensambladas (también conocidas por la sigla en inglés SAM) son agrupaciones espontáneas de moléculas orgánicas formadas por adsorción sobre superficies y organizadas en dominios ordenados más o menos amplios.[1][2] En algunos casos, las moléculas que forman la monocapa no interactúan fuertemente con el sustrato. Este es el caso, por ejemplo, de las redes supramoleculares bidimensionales[3] de, por ejemplo, dianhídrido perilentetracarboxílico sobre oro[4] o de porfirinas sobre grafito pirolítico altamente orientado.[5] En otros casos, las moléculas poseen un grupo de cabeza o ligando con alta afinidad por el sustrato por el que se adhieren a él; tioles, silanos y fosfonatos están entre los ligandos comunes.
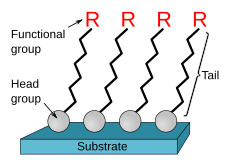
La formación de monocapas autoensambladas se inicia mediante la quimisorción de los ligandos a un sustrato desde la fase de vapor o líquida,[6][7] seguida por una organización lenta de los grupos de cola.[8] Al comienzo, cuando la densidad molecular en la superficie es baja, las moléculas de adsorbato forman una masa desordenada o forman una «fase tumbada» bidimensional ordenada;[6] al aumentar la cobertura de la superficie, durante un período de minutos a horas, comienzan a formarse estructuras cristalinas o semicristalinas tridimensionales en la superficie del sustrato.[9] Los grupos de cabeza se disponen sobre el sustrato, mientras que los grupos de cola se orientan lejos de la superficie. Las áreas de moléculas compactas forman núcleos que crecen hasta que la superficie del sustrato se cubre con una sola monocapa.
Las moléculas de adsorbato reducen la energía libre superficial del sustrato[1] y son estables debido a la fuerte quimisorción de los ligandos. Las monocapas resultantes son más estables que los enlaces fisisorbidos de las películas de Langmuir-Blodgett.[10][11] Un ligando basado en triclorosilano, como el de la molécula de FDTS, reacciona con un grupo hidroxilo en un sustrato y forma un enlace covalente muy estable [sustrato R-Si-O] con una energía de 452 kJ/mol. Los enlaces tiol-metal son del orden de 100 kJ/mol, lo que los hace bastante estables en una variedad de temperaturas, solventes y voltajes.[9] La monocapa se empaqueta fuertemente debido a interacciones de van der Waals,[1][11] lo que reduce su propia energía libre.[1] La adsorción puede describirse mediante la isoterma de adsorción de Langmuir si no se tienen en cuenta las interacciones laterales; si estas no son negligibles, la adsorción se describe mejor mediante la isoterma de Frumkin.[9]
Tipos
[editar]La selección del ligando depende del uso que se le vaya dar a la monocapa.[1] Por lo general, el grupo de cabeza está conectado a una cadena molecular o grupo espaciador cuyo extremo terminal puede portar un grupo funcional —como, por ejemplo, OH, NH2, COOH o SH— que modifica las propiedades humectantes e interfaciales.[10] El sustrato se escoge en función de su afinidad por el ligando. Los sustratos pueden ser superficies planas, como el silicio y los metales, o superficies curvas, formadas por nanopartículas. Los alcanotioles son las moléculas más utilizadas para las monocapas autoensambladas. Estas moléculas constan de un grupo espaciador formado por una cadena de alquilo (CC)ⁿ, un grupo de cola y un grupo de cabeza SH. Los tioles aromáticos son de interés en la electrónica molecular; en ellos, la cadena de alcano se reemplaza parcialmente por anillos aromáticos. Un ejemplo es el ditiol 1,4-bencenodimetanotiol (SHCH2C6H4CH2SH). Con estos ditioles existe la posibilidad de vincular los dos extremos de azufre a contactos metálicos, que se utilizó por primera vez en mediciones de conducción molecular.[12] Los metales nobles son el sustrato preferido para los tioles, debido a la afinidad del azufre por estos metales. La interacción azufre-oro es semicovalente y tiene una fuerza de aproximadamente 45 kcal/mol. Además, el oro es un material inerte, biocompatible, disponible y fácil de modelar mediante litografía, una función útil para aplicaciones nanotecnológicas.[1] Además, puede soportar tratamientos químicos de limpieza abrasivos.[9]
Entre las moléculas examinadas más recientemente se encuentran los calcogenuros (seleniuros y telururos),[13][14] por poseer diferentes características de unión a sustratos que podrían ser de interés en algunas aplicaciones como la electrónica molecular.
Los silanos se usan generalmente en superficies de óxidos no metálicos;[1] sin embargo, las monocapas formadas a partir de enlaces covalentes entre el silicio y el carbono o el oxígeno no pueden considerarse autoensambladas porque no se forman de forma reversible. Las monocapas autoensambladas de tiolatos sobre metales nobles son un caso especial porque los enlaces metal-metal se vuelven reversibles después de la formación del complejo tiolato-metal.[15] Esta reversibilidad es la que da lugar a las islas de vacancia y es la razón por la cual las monocapas autoensambladas de alcanotiolatos pueden desorberse térmicamente e intercambiarse con tioles libres.[16]
Preparación
[editar]Los sustratos metálicos para el autoensamblaje de monocapas se pueden producir mediante técnicas de deposición física de vapor, electrodeposición o deposición sin electricidad.[1] Las monocapas compuestas de moléculas con grupos tiol o selenio se suelen generar sumergiendo el sustrato en una solución diluida de alcanotiol en etanol, aunque se pueden usar otros solventes diferentes, así como líquidos puros.[1][14] Típicamente las monocapas tardan entre 12 y 72 horas en formarse a temperatura ambiente,[9][17] pero los alcanotiolatos se autoensamblan en cuestión de minutos.[18][19] En algunos casos, como el de los compuestos con ditiol, es necesario evitar procesos de oxidación o fotoinducción, que pueden afectar a los grupos terminales y provocar desorden y la formación de multicapas;[20][21] para ello, la elección del disolvente apropiado, la desgasificación con gases inertes y la preparación en ausencia de luz son cruciales para la formación de monocapas con grupos SH libres.[20][21] Las monocapas autoensambladas también se pueden adsorber desde la fase de vapor.[7][22]
Cuando es difícil obtener un ensamblaje ordenado o cuando se necesita obtener fases de diferentes densidades, se utiliza el autoensamblaje sustitutivo, consistente en formar la monocapa ordenada de un determinado tipo de moléculas, para luego realizar una segunda fase de ensamblaje —por ejemplo, por inmersión en una solución diferente—. Este método también se ha utilizado para brindar información sobre las fuerzas de unión relativas de las monocapas con diferentes grupos de cabeza y, de manera más general, sobre las características del autoensamblaje.[16][23]
Técnicas de caracterización
[editar]El espesor de una monocapa autoensamblada se mide mediante la elipsometría y la espectroscopia de fotoelectrones de rayos X (XPS), que también ofrecen información sobre las propiedades interfaciales.[20][24] El grado de orden y la orientación de las moléculas en la mmonocapa se pueden estudiar mediante las técnicas de espectroscopia de estructura fina cerca del borde de absorción de rayos X y espectroscopia de infrarrojo por transformada de Fourier en espectroscopia de infrarrojo por absorción de reflexión (RAIRS).[18][21] Otras técnicas espectroscópicas usadas para este fin incluyen la generación de segundo armónico (SHG), la generación de suma de frecuencia (SFG), la dispersión Raman de superficie mejorada (SERS), así como la espectroscopia de pérdida de energía de electrones de alta resolución (HREELS).[7][25]
La estructura de las monocapas se determina comúnmente mediante técnicas de microscopía de sonda de barrido, como la microscopía de fuerza atómica (AFM) y la microscopía de túnel de barrido (STM). La STM ha ayudado a comprender los mecanismos de formación de las monocapas autoensambladas, y a determinar las características estructurales importantes que les otorgan su integridad como entidades estables en una superficie. En particular, la STM genera imágenes de la forma, la distribución espacial, los grupos terminales y su empaquetamiento. La técnica de AFM, por su lado se puede utilizar independientement de que la monocapa sea conductora o semiconductora, y sirve para determinar la funcionalidad química, la conductancia, las propiedades magnéticas, la carga superficial y las fuerzas de fricción de las monocapas.[26] La técnica del electrodo vibratorio de barrido (SVET) es otra microscopía de sonda de barrido usada para caracterizar las monocapas.[27]
Más recientemente también se han utilizado métodos de difracción para caracterizar la cinética y los defectos en la superficie de la monocapa.[1] Estas técnicas también han mostrado diferencias físicas entre monocapas ensambladas sobre sustratos planos y sustratos de nanopartículas. Otros instrumentos de caracterización para medir el autoensamblaje en tiempo real son la interferometría de polarización dual, donde el índice de refracción, el espesor, la masa y la birrefringencia de la capa autoensamblada se cuantifican a alta resolución; y la microbalanza de cristal de cuarzo con monitorización de disipación, que cuantifica las propiedades viscoelásticas y de masa de la capa adsorbida. Las mediciones del ángulo de contacto se usan para determinar la energía libre de la superficie, que refleja la composición promedio de la superficie de la monocapa, y para sondear la cinética y la termodinámica del autoensamblado de la monocapa.[18][19] La cinética de la adsorción y la desorción inducidas por la temperatura, así como la información sobre la estructura, también se obtienen en tiempo real mediante técnicas de dispersión de iones, como la dispersión de iones de baja energía (LEIS) y la espectroscopia de retroceso directo de tiempo de vuelo (TOFDRS).[22]
Defectos
[editar]Los defectos en las monocapas autoensambladas pueden deberse tanto a factores externos como intrínsecos. Los factores externos incluyen la limpieza del sustrato, el método de preparación y la pureza de los adsorbatos.[1][9] Los defectos intrínsecos se deben a efectos termodinámicos durante la formación: por ejemplo, las monocapas de tiol sobre oro suelen exhibir dislocaciones (islas monoatómicas vacantes) probablemente a causa de la extracción de átomos del sustrato y la formación de moléculas de átomo-adsorbato. Recientemente, se ha descubierto un nuevo tipo de fluorotensioactivos que pueden formar una monocapa casi perfecta sobre un sustrato de oro debido al aumento de la movilidad de los átomos de oro en la superficie.[28][29][30]
Propiedades de las nanopartículas
[editar]La estructura de las monocapas depende de la curvatura del sustrato. Al autoensamblarse sobre nanopartículas, coloides y nanocristales, las monocapas «estabilizan la superficie reactiva de la partícula y presentan grupos funcionales orgánicos en la interfaz partícula-disolvente».[1] Estos grupos funcionales orgánicos son útiles para inmunoensayos o sensores, aplicaciones que dependen de la composición química de la superficie.[1]
Cinética de formación
[editar]El autoensamblaje de las monocapas ocurre en dos pasos: una rápida adsorción inicial, seguida de una estructuración más lenta de la monocapa.
La adsorción ocurre en las interfases líquido-líquido, líquido-vapor y líquido-sólido. El transporte de moléculas a la superficie ocurre gracias a una combinación de difusión y transporte convectivo. Según el modelo cinético de Langmuir o Avrami, la tasa de deposición sobre la superficie es proporcional al espacio libre de la superficie:[6]
Donde es la extensión proporcional de área depositada y es la constante de velocidad. Aunque este modelo es robusto, solo se usa para aproximaciones porque no tiene en cuenta los procesos intermedios.[6] La Interferometría de polarización dual, una técnica con ~10 Hz de resolución temporal, puede evaluar experimentalmente la cinética del autoensamblaje de la monocapa.
Una vez que las moléculas se encuentran sobre la superficie, la autoorganización ocurre en tres fases:[6]
- 1. Una fase de baja densidad con dispersión aleatoria de las moléculas en la superficie.
- 2. Una fase de densidad intermedia, con moléculas en múltiples conformaciones o moléculas que yacen planas en la superficie.
- 3. Una fase de alta densidad, con moléculas dispuestas de forma compacta y normales a la superficie del sustrato.
Las transiciones entre las fases de formación dependen de la temperatura del entorno en relación con la temperatura del punto triple -la temperatura en la que el extremo de la fase de baja densidad se cruza con la región de la fase intermedia-. A temperaturas por debajo del punto triple, la estructura pasa de la primera a la segunda fase 2, con islas de monocapas perfectamente ensambladas rodeadas de moléculas dispuestas aleatoriamente. De forma similar al proceso de nucleación en metales, a medida que las islas crecen, se encuentran y reforman hasta acabar en la fase tercera, como se ve a continuación.[6]
A temperaturas por encima del punto triple el crecimiento es más complejo y puede tomar dos caminos. En el primer camino, las cabezas del SAM se organizan hasta sus ubicaciones casi finales con los grupos de cola formados libremente en la parte superior. Luego, a medida que pasan a la fase 3, los grupos de cola se ordenan y se enderezan. En el segundo camino, las moléculas comienzan en una posición acostada a lo largo de la superficie. Estos luego forman islas de SAM ordenados, donde crecen hasta la tercera fase.[6]
La autoorganización de los grupos de cola en una monocapa ordenada recta depende de la atracción intermolecular, o fuerzas de van der Waals, entre ellos. Para minimizar la energía libre de la capa, las moléculas adoptan conformaciones que permiten un alto grado de fuerzas de Van der Waals con algunos enlaces de hidrógeno. El pequeño tamaño de las moléculas es importante porque las fuerzas de Van der Waals surgen de los dipolos moleculares y son mucho más débiles que las fuerzas de superficie a escalas más grandes. El proceso de ensamblaje comienza con un pequeño grupo de moléculas, generalmente dos, que se acercan lo suficiente como para que las fuerzas de Van der Waals superen la fuerza circundante. Las fuerzas entre las moléculas definen su configuración óptima. Luego, a medida que otras moléculas se acercan, interactúan con estas moléculas ya organizadas de la misma manera y se convierten en parte del grupo conformado. Cuando esto ocurre en un área grande, las moléculas se apoyan entre sí para formar una capa como la de la figura 1.
La orientación de las moléculas se puede describir con dos parámetros: α y β. α es el ángulo de inclinación de la molécula respecto al eje normal a la superficie. En aplicaciones típicas, α varía de 0 a 60 grados según el sustrato y el tipo de molécula. β es el ángulo de rotación a lo largo del eje largo de la molécula. β suele estar entre 30 y 40 grados.[1] En algunos casos se ha señalado la existencia de «trampas cinéticas» que dificultan una orientación final ordenada.[7] Por ejemplo, la formación de una fase aplanada sobre la superficie en el caso de los ditioles se ha considerado un impedimento para la formación de una fase «de pie», aunque varios estudios recientes indican que este no es el caso.[20][21]
Muchas de las propiedades de las monocapas, como su espesor, quedan determinadas en los primeros minutos. Sin embargo, pueden pasar horas hasta que se eliminen los defectos mediante el recocido y hasta la monocapa adquiera sus propiedades finales.[6][9] En la práctica, las propiedades cinéticas dependen tanto de las condiciones de preparación como de las propiedades del material del solvente, el adsorbato y el sustrato.[6] Específicamente, la cinética de adsorción de una solución líquida depende de los siguientes factores:[1]
- Temperatura: la preparación a temperatura ambiente mejora la cinética y reduce los defectos.
- Concentración de adsorbato en la solución: las concentraciones bajas requieren tiempos de inmersión más prolongados y, a menudo, crean dominios muy cristalinos.[1][9]
- Pureza del adsorbato: las impurezas afectan a las propiedades físicas finales de la monocapa
- Suciedad o contaminación en el sustrato: las imperfecciones pueden causar defectos en la monocapa
La estructura final también depende de la longitud de la cadena molecular y de la estructura del adsorbato y del sustrato. Los impedimentos estéricos y las propiedades del sustrato metálico, por ejemplo, pueden afectar la densidad de empaquetamiento de la película,[1][9] mientras que la longitud de la cadena afecta al espesor de la monocapa.[11] Las moléculas de mayor longitud tienden tener más estabilidad termodinámica.[1]
Formación de nanoestructuras
[editar]Las monocapas autoemsambladas pueden disponerse en patrones o trazados determinados sobre la superficie para formar parte de estructuras con aplicaciones interesantes en campos como la nanoelectrónica. Existen tres estrategias principales para formar nanoestructuras con monocapas:
Atracción local
[editar]Esta primera estrategia consiste en depositar localmente las monocapas solo en las partes de la superficie donde se ubicará posteriormente la nanoestructura. Esta estrategia es ventajosa porque emplea métodos de alto rendimiento que generalmente comprenden el menor número de etapas. Las principales técnicas basadas en esta estrategia son la impresión por microcontacto y la nanolotografía por inmersión de pluma.[31]
- Impresión por microcontacto
La impresión por microcontacto o litografía blanda es análoga a la impresión de tinta con un sello de goma. Las moléculas de la monocapa en solución se disponen sobre un sello elastomérico preformateado y se transfieren a la superficie del sustrato por estampado. La solución se aplica a todo el sello, pero solo las áreas que hacen contacto con la superficie del sustrato permiten la transferencia de las monocapas. La transferencia es un proceso de difusión complejo que depende del tipo de molécula, su concentración, la duración del contacto y la presión aplicada. Los sellos típicos usan dimeticona por sus propiedades elastoméricas, que le permiten adaptarse al contorno de las microsuperficies, y su baja energía superficial. Este proceso puede paralelizarse para depositar nanoestructuras en un área grande en poco tiempo.[1]
- Nanolitografía por inmersión de pluma
La nanolitografía por inmersión de pluma o nanolitografía dip-pen es un proceso que utiliza un microscopio de fuerza atómica para transferir moléculas de la punta del microscopio a un sustrato. Inicialmente, la punta se sumerge en un depósito con una «tinta» de moléculas en solución. La tinta se evapora y deja las moléculas adheridas a la punta. Cuando la punta se pone en contacto con la superficie, se forma un menisco de agua entre ambas y las moléculas se difunden hacia la superficie. El radio de las puntas del microscopio mide tan solo unas decenas de nanómetros, por lo que las moléculas SAM se pueden depositar con mucha precisión en una ubicación específica de la superficie. Este proceso fue descubierto por Chad Mirkin y sus compañeros de trabajo en la Universidad del Noroeste.[32]
Eliminación local
[editar]La estrategia de eliminación local consiste en cubrir la totalidad del sustrato con una monocapa autoensamblada para luego eliminar las moléculas en los lugares donde no se desea la deposición. El resultado es el mismo que en la estrategia de atracción local. Las moléculas pueden retirarse mecánicamente o mediante degradación por ionización.[31]
- Eliminación o desorción con un microscopio de efecto túnel
El microscopio de efecto túnel puede eliminar moléculas de una monocapa de maneras diferentes. Una forma es retirarlas mecánicamente arrastrando la punta del microscopio por la superficie del sustrato. Esta no es la técnica más deseada ya que las puntas son caras y arrastrarlas provoca mucho desgaste y reducción de calidad. Otra manera consiste en degradar o desorber las moléculas disparándolas con un haz de electrones. El microscopio de efecto túnel también puede eliminar las moléculas mediante la aplicació de un campo eléctrico, por desorción de campo y difusión de superficie acelerada por el campo.[31]
- Rasurado o nanolitografía con un microscopio de fuerza atómica
El uso más común de esta técnica es eliminar las moléculas en un proceso llamado rasurado, donde la punta del microscopio de fuerza atómica se arrastra por la superficie para destruir mecánicamente las moléculas. El microscopio de fuerza atómica también puede eliminar moléculas SAM mediante nanolitografía de oxidación local.
- Irradiación ultravioleta
En este proceso, la radiación ultravioleta se proyecta sobre la superficie cubierta por la monocapa a través de aperturas en una película de cromo. La irradiación fotooxida las moléculas, que se retiran a continuación con un disolvente polar. Este proceso tiene una resolución del orden de 100 nanómetros y requiere un tiempo de exposición de 15-20 minutos.[1]
Modificación de los grupos de cola
[editar]El grupo terminal se puede modificar para eliminar su funcionalidad —de modo que las molécula de partes de la monocapa sean inertes— o para agregar una funcionalidad,[33] para que pueda aceptar diferentes materiales o tener propiedades diferentes a las de la monocapa original. La exposición a un haz de electrones enfocado o la irradiación ultravioleta cambian la propiedades químicas del grupo terminal mediante la rotura de enlaces, la formación de dobles enlaces de carbono, el entrecruzamiento de moléculas adyacentes, la fragmentación de moléculas y el desorden conformacional.[1] [31] La punta conductora de un microscopio de fuerza atómica también puede crear una reacción electroquímica para alterar los grupos terminales.[31]
Aplicaciones
[editar]Las monocapas autoensambladas son un recubrimiento superficial económico y versátil para aplicaciones como el control de la humectación y la adhesión,[34] la resistencia química, la biocompatibilidad, la sensibilización y el reconocimiento molecular para sensores[35] y la nanofabricación.[6] Las áreas de aplicación comprenden la biología, la electroquímica y la electrónica, los sistemas nanoelectromecánicos (NEMS) y microelectromecánicos (MEMS) así como la manufactura de artículos domésticos cotidianos.[1]
En biología, las monocapas pueden servir como modelos para estudiar las propiedades de la membrana celular y los orgánulos y la unión de las células a las superficies.[1] En la electroquímica, las propiedades de los SAM se usan para controlar la transferencia de electrones.[36] Pueden proteger los metales expuestos a productos químicos agresivos y reducir la adherencia de los componentes NEMS y MEMS en entornos húmedos. Un producto doméstico común, Rain-X, se basa en monocapas autoensambladas para crear una cubierta hidrofóbica en los parabrisas de los automóviles. Otra aplicación es el recubrimiento antiadherente en herramientas y sellos para Litografía de nanoimpresión (NIL). Las monocapas de perfluordeciltriclorosilano pueden recubrir las herramientas de moldeo por inyección para la replicación de polímeros.[37]
Las monocapas de película delgada pueden formar parte de nanoestructuras, para posibilitar la unión selectiva con otras moléculas o monocapas. Esta tecnología tiene aplicaciones en biosensores u otros dispositivos MEMS que necesiten separar un tipo de molécula de su entorno; un ejemplo es el uso de nanopartículas magnéticas para eliminar un hongo del torrente sanguíneo. La nanopartícula está recubierta con una monocapa capaz de unirse al hongo. A medida que la sangre contaminada se filtra a través de un dispositivo MEMS, las nanopartículas magnéticas capturan el hongo y luego se expulsan magnéticamente del torrente sanguíneo.[38]
Construcción de nanoestructuras
[editar]Las monocapas son útiles para la formación de nanoestructuras complejas, porque cada molécula de adsorbato se puede adaptar para atraer dos materiales diferentes: mientras que los grupos de cabza se adhieren al sustrato, los grupos terminales atraen materiales específicos, como nanopartículas, cables, cintas u otras nanoestructuras. Un ejemplo de esta aplicación es el uso de dos tipos de monocapas para alinear nanotubos de carbono de pared simple: Mediante la nanolitografía de inmersión de pluma se forma una monocapa de ácido 16-mercaptohexadecanoico (MHA) y el resto de la superficie del sustrato se recubre con otra monocapa de 1-octadecanotiol (ODT). El MHA hidrofílico atrae el solvente polar que transporta los nanotubos; a medida que el solvente se evapora, los nanotubos se ligan al MHA por fuerzas de Van der Waals y se alinean así en la frontera entre el MHA y el ODT. Usando esta técnica, Mirkin, Schatz y sus colaboradores han logrado generar formas bidimensionales complejas.[31]
Una aplicación de la impresión de monocapas autoensambladas es la funcionalización de biosensores mediante la modificación de los grupos terminales para que se unan a células, proteínas o moléculas de diversos tipos. La capacidad de disponer las monocapas en configuraciones que aumentan la sensibilidad y no dañan ni interfieren con otros componentes del biosensor es importante en estas aplicaciones.[26]
Superredes orgánicas metálicas
[editar]Existe un interés considerable en el uso de SAM para nuevos materiales, por ejemplo, mediante la formación de superredes orgánicas metálicas bidimensionales o tridimensionales por el ensamblaje de nanopartículas cubiertas con manocapas.[39] o multicapas compuestas de nanopartículas recubiertas por monocapas autoensambladas basadas en ditioles.[40] Hamoudi y Esaulov han publicado un informe detallado sobre este tema.[41]
Referencias
[editar]- ↑ a b c d e f g h i j k l m n ñ o p q r s t u v Love et al. (2005). «Self-Assembled Monolayers of Thiolates on Metals as a Form of Nanotechnology». Chem. Rev. (en inglés) 105 (4): 1103-1170. PMID 15826011. doi:10.1021/cr0300789.
- ↑ Barlow, S.M.; Raval R.. (2003). «Complex organic molecules at metal surfaces: bonding, organisation and chirality». Surface Science Reports (en inglés) 50 (6–8): 201-341. Bibcode:2003SurSR..50..201B. doi:10.1016/S0167-5729(03)00015-3.
- ↑ Elemans, J.A.A.W.; Lei S., De Feyter S. (2009). «Molecular and Supramolecular Networks on Surfaces: From Two-Dimensional Crystal Engineering to Reactivity». Angew. Chem. Int. Ed. (en inglés) 48 (40): 7298-7332. PMID 19746490. doi:10.1002/anie.200806339.
- ↑ Witte, G.; Wöll Ch. (2004). «Growth of aromatic molecules on solid substrates for applications in organic electronics». Journal of Materials Research (en inglés) 19 (7): 1889-1916. Bibcode:2004JMatR..19.1889W. doi:10.1557/JMR.2004.0251.
- ↑ De Feyter, S.; De Schreyer F.C. (2003). «Two-dimensional supramolecular self-assembly probed by scanning tunneling microscopy». Chemical Society Reviews (en inglés) 32 (3): 139-150. PMID 12792937. doi:10.1039/b206566p.
- ↑ a b c d e f g h i j Schwartz, D.K., Mechanisms and Kinetics of Self-Assembled Monolayer Formation (2001). «Mechanisms and kinetics of self-assembled monolayer formation». Annu. Rev. Phys. Chem. (en inglés) 52: 107-37. Bibcode:2001ARPC...52..107S. PMID 11326061. doi:10.1146/annurev.physchem.52.1.107.
- ↑ a b c d Schreiber, F (30 de noviembre de 2000). «Structure and growth of self-assembling monolayers». Progress in Surface Science (en inglés) 65 (5–8): 151-257. Bibcode:2000PrSS...65..151S. doi:10.1016/S0079-6816(00)00024-1.
- ↑ Wnek, Gary, Gary L. Bowlin (2004). Encyclopedia of Biomaterials and Biomedical Engineering (en inglés). Informa Healthcare. pp. 1331-1333.
- ↑ a b c d e f g h i Vos, Johannes G., Robert J. Forster, Tia E. Keyes (2003). Interfacial Supramolecular Assemblies (en inglés). Wiley. pp. 88-94.
- ↑ a b Madou, Marc (2002). Fundamentals of Microfabrication: The Science of Miniaturization (en inglés). CRC. pp. 62-63.
- ↑ a b c Kaifer, Angel (2001). Supramolecular Electrochemistry. Coral Gables (en inglés). Wiley VCH. pp. 191-193.
- ↑ Andres, R.P.; Bein T.; Dorogi M.; Feng S.; Henderson J.I.; Kubiak C.P.; Mahoney W.; Osifchin R.G. et al. (1996). «Coulomb Staircase at Room Temperature in a Self-Assembled Molecular Nanostructure». Science (en inglés) 272 (5266): 1323-1325. Bibcode:1996Sci...272.1323A. PMID 8662464. doi:10.1126/science.272.5266.1323.
- ↑ Shaporenko, A.; Muller J.; Weidner T.; Terfort A.; Zharnikov M. (2007). «Balance of Structure-Building Forces in Selenium-Based Self-Assembled Monolayers». Journal of the American Chemical Society (en inglés) 129 (8): 2232-2233. PMID 17274618. doi:10.1021/ja068916e.
- ↑ a b Subramanian, S.; Sampath S. (2007). «Enhanced stability of short- and long-chain diselenide self-assembled monolayers on gold probed by electrochemistry, spectroscopy, and microscopy». Journal of Colloid and Interface Science (en inglés) 312 (2): 413-424. Bibcode:2007JCIS..312..413S. PMID 17451727. doi:10.1016/j.jcis.2007.03.021.
- ↑ Bucher, Jean-Pierre; Santesson, Lars, Kern, Klaus (31 de marzo de 1994). «Thermal Healing of Self-Assembled Organic Monolayers: Hexane- and Octadecanethiol on Au(111) and Ag(111)». Langmuir (en inglés) 10 (4): 979-983. doi:10.1021/la00016a001.
- ↑ a b Schlenoff, Joseph B.; Li, Ming, Ly, Hiep (30 de noviembre de 1995). «Stability and Self-Exchange in Alkanethiol Monolayers». Journal of the American Chemical Society (en inglés) 117 (50): 12528-12536. doi:10.1021/ja00155a016.
- ↑ Wysocki. «Self-Assembled Monolayers (SAMs) as Collision Surfaces for Ion Activation» (en inglés). Archivado desde el original el 22 de junio de 2010.
- ↑ a b c Nuzzo, Ralph G.; Allara, David L. (31 de mayo de 1983). «Adsorption of bifunctional organic disulfides on gold surfaces». Journal of the American Chemical Society (en inglés) 105 (13): 4481-4483. doi:10.1021/ja00351a063.
- ↑ a b Bain, Colin D.; Troughton, E. Barry; Tao, Yu Tai; Evall, Joseph; Whitesides, George M.; Nuzzo, Ralph G. (31 de diciembre de 1988). «Formation of monolayer films by the spontaneous assembly of organic thiols from solution onto gold». Journal of the American Chemical Society (en inglés) 111 (1): 321-335. doi:10.1021/ja00183a049. Archivado desde el original el 23 de septiembre de 2017.
- ↑ a b c d Hamoudi, H.; Prato M., Dablemont C., Cavalleri O., Canepa M., Esaulov, V. A. (2010). «Self-Assembly of 1,4-Benzenedimethanethiol Self-Assembled Monolayers on Gold». Langmuir (en inglés) 26 (10): 7242-7247. PMID 20199099. doi:10.1021/la904317b.
- ↑ a b c d Hamoudi, H.; Guo Z.,Prato M., Dablemont C., Zheng W.Q., Bourguignon B., Canepa M., Esaulov, V. A.; Prato, Mirko; Dablemont, Céline; Zheng, Wan Quan; Bourguignon, Bernard; Canepa, Maurizio; Esaulov, Vladimir A. (2008). «On the self assembly of short chain alkanedithiols». Physical Chemistry Chemical Physics (en inglés) 10 (45): 6836-6841. Bibcode:2008PCCP...10.6836H. PMID 19015788. doi:10.1039/B809760G.
- ↑ a b Alarcon, L.S.; Chen L., Esaulov, V. A., Gayone J.E., Sanchez E., Grizzi O. (2010). «Thiol Terminated 1,4-Benzenedimethanethiol Self-Assembled Monolayers on Au(111) and InP(110) from Vapor Phase». Journal of Physical Chemistry C (en inglés) 114 (47): 19993-19999. doi:10.1021/jp1044157.
- ↑ Chaudhari, V.; Harish N.M.K.; Sampath S.; Esaulov V.A. (2011). «Substitutional Self-Assembly of Alkanethiol and Selenol SAMs from a Lying-Down Doubly Tethered Butanedithiol SAM on Gold». Journal of Physical Chemistry C (en inglés). 115 número=33: 16518-16523. doi:10.1021/jp2042922.
- ↑ Prato, M.; Moroni R.; Bisio F.; Rolandi R.; Mattera L.; Cavalleri O.; Canepa M. (2008). «Optical Characterization of Thiolate Self-Assembled Monolayers on Au(111)». Journal of Physical Chemistry C (en inglés) 112 (10): 3899-3906. doi:10.1021/jp711194s.
- ↑ Kato, H.; Noh J.; Hara M.; Kawai M. (2002). «An HREELS Study of Alkanethiol Self-Assembled Monolayers on Au(111)». Journal of Physical Chemistry C (en inglés) 106 (37): 9655-9658. doi:10.1021/jp020968c.
- ↑ a b Smith et al. (2004). «Patterning Self-Assembled Monolayers». Progress in Surface Science (en inglés) 75 (1–2): 1-68. Bibcode:2004PrSS...75....1S. doi:10.1016/j.progsurf.2003.12.001.
- ↑ Laffineur, F.; Auguste, D.; Plumier, F.; Pirlot, C.; Hevesi, L.; Delhalle, J.; Mekhalif, Z. (2004). «Comparison between CH3(CH2)15SH and CF3(CF2)3(CH2)11SH Monolayers on Electrodeposited Silver». Langmuir (en inglés) 20 (8): 3240-3245. ISSN 0743-7463. PMID 15875853. doi:10.1021/la035851+.
- ↑ Tang, Yongan; Yan, Jiawei; Zhou, Xiaoshun; Fu, Yongchun; Mao, Bingwei (2008). «An STM study on nonionic fluorosurfactant zonyl FSN self-assembly on Au(111) large domains, few defects, and good stability». Langmuir (en inglés) 24 (23): 13245-13249. PMID 18980356. doi:10.1021/la802682n.
- ↑ Yan, Jiawei; Tang, Yongan; Sun, Chunfeng; Su, Yuzhuan; Mao, Bingwei (2010). «STM Study on Nonionic Fluorosurfactant Zonyl FSN Self-Assembly on Au(100) (3/1/-1/1) Molecular Lattice, Corrugations, and Adsorbate-Enhanced Mobility». Langmuir (en inglés) 26 (6): 3829-3834. PMID 20058870. doi:10.1021/la903250m.
- ↑ Tang, Yongan; Yan, Jiawei; Zhu, Feng; Sun, Chunfeng; Mao, Bingwei (2011). «Comparative electrochemical scanning tunneling microscopy study of nonionic fluorosurfactant zonyl FSN self-assembled monolayers on Au(111) and Au(100) a potential-induced structural transition». Langmuir (en inglés) 27 (3): 943-947. PMID 21214202. doi:10.1021/la103812v.
- ↑ a b c d e f Seong, Jin Koh (2007). «Strategies for Controlled Placement of Nanoscale Building Blocks». Nanoscale Res. Lett. (en inglés) 2 (11): 519-545. Bibcode:2007NRL.....2..519K. PMC 3246612. PMID 21794185. doi:10.1007/s11671-007-9091-3.
- ↑ Piner, R.D; Zhu, J; Xu, F; Hong, S; Mirkin, C.A (1999). «Dip-Pen Nanolithography». Science (en inglés) 283 (5402): 661-663. PMID 9924019. doi:10.1126/science.283.5402.661.
- ↑ Lud, S.Q.; Neppl, .S; Xu, F.; Feulner, P.; Stutzmann, M.; Jordan, Rainer; Feulner, Peter; Stutzmann, Martin et al. (2010). «Controlling Surface Functionality through Generation of Thiol Groups in a Self-Assembled Monolayer». Langmuir (en inglés) 26 (20): 15895-900. PMID 20845943. doi:10.1021/la102225r.
- ↑ Laibinis, Paul E.; Whitesides, George M.; Allara, David L.; Tao, Yu Tai; Parikh, Atul N.; Nuzzo, Ralph G. (1 de septiembre de 1991). «Comparison of the structures and wetting properties of self-assembled monolayers of n-alkanethiols on the coinage metal surfaces, copper, silver, and gold». Journal of the American Chemical Society (en inglés) 113 (19): 7152-7167. ISSN 0002-7863. doi:10.1021/ja00019a011.
- ↑ Noyhouzer, Tomer; Mandler, Daniel (17 de enero de 2011). «Determination of low levels of cadmium ions by the under potential deposition on a self-assembled monolayer on gold electrode». Analytica Chimica Acta (en inglés) 684 (1–2): 1-7. PMID 21167979. doi:10.1016/j.aca.2010.10.021.
- ↑ Lud, S.Q; Steenackers, M; Bruno, P; Gruen, D.M; Feulner, P; Garrido, J.A; Stutzmann, M; Stutzmann, M (2006). «Chemical Grafting of Biphenyl Self-Assembled Monolayers on Ultrananocrystalline Diamond». Journal of the American Chemical Society 128 (51): 16884-16891. PMID 17177439. doi:10.1021/ja0657049.
- ↑ Cech J; Taboryski R (2012). «Stability of FDTS monolayer coating on aluminum injection molding tools». Applied Surface Science (en inglés) 259: 538-541. Bibcode:2012ApSS..259..538C. doi:10.1016/j.apsusc.2012.07.078.
- ↑ Yung; Fiering, J; Mueller, A.J.; Ingber, D.E. (2009). «Micromagnetic–microfluidic blood cleansing device». Lab on a Chip (en inglés) 9 (9): 1171-1177. PMID 19370233. doi:10.1039/b816986a.
- ↑ Kiely, C.J.; Fink J., Brust M., Bethell D? Schiffrin D.J. (1999). «Spontaneous ordering of bimodal ensembles of nanoscopic gold clusters». Nature 396 (3): 444-446. Bibcode:1998Natur.396..444K. doi:10.1038/24808.
- ↑ Vijaya Sarathy, K.; John Thomas P.,Kulkarni G.U., Rao C.N.R. (1999). «Superlattices of Metal and Metal−Semiconductor Quantum Dots Obtained by Layer-by-Layer Deposition of Nanoparticle Arrays». Journal of Physical Chemistry 103 (3): 399-401. doi:10.1021/jp983836l.
- ↑ Hicham Hamoudi; Vladimir Esaulov (2016). «Selfassembly of α, ω‐dithiols on surfaces and metal dithiol heterostructures». Annalen der Physik (en inglés) 528: 242-263. doi:10.1002/andp.201500280l.
Enlaces externos
[editar]- «Monocapas Autoensambladas Parte I - Studocu». Universidad de Alicante. Consultado el 28 de julio de 2023.


