Nomenclatura química de los compuestos orgánicos
La nomenclatura química de los compuestos orgánicos (del griego ονοματοκλήτωρ; όνομα, nombre, y κλήτωρ, llamar). El término latino nomenclatūra se refiere a una lista de nombres, al igual que al nomenclador; esta palabra puede indicar un proveedor o el locutor de los nombres, en química orgánica es una metodología establecida para denominar y agrupar los compuestos orgánicos.[1]
Nombrar "cosas" es una parte de nuestra comunicación en general por uso de palabras y el lenguaje: es un aspecto de la taxonomía cotidiana para distinguir los objetos de nuestra experiencia, junto con sus similitudes y diferencias, para identificar, nombrar y clasificar. El uso de nombres, así como los diferentes tipos de sustantivos incorporados en diferentes idiomas, conecta a la nomenclatura con la lingüística teórica, mientras que la forma de la estructura mental que se utiliza para comprender el mundo en relación con el significado de las palabras se estudia a través de la lógica conceptual y la filosofía del lenguaje.[2]
Actualmente, la Unión Internacional de Química Pura y Aplicada (IUPAC) es la máxima autoridad en materia de nomenclatura química, la cual se encarga de establecer las reglas correspondientes.[3]
Las cadenas de Simplified Molecular Input Line Entry Specification (SMILES) se utilizan de forma común para describir compuestos orgánicos, y es una forma de "denominarlos".[4]
Historia
[editar]A principios del siglo XIX la química inorgánica contaba con un método para acuñar nuevos términos, basado en una nomenclatura binomial que indicaba la composición y la proporción de los elementos en los compuestos. Este tipo de nomenclatura binomial era, además, coherente con las teorías electroquímicas vigentes en ese período. Los compuestos inorgánicos conocidos durante el siglo XIX estaban formados por un grupo relativamente grande de elementos - alrededor de sesenta a mediados del siglo- combinados según un limitado número de proporciones relativas. Para nombrar estas sustancias de acuerdo con esta nomenclatura bastaba con emplear las raíces de los nombres de los elementos y un reducido conjunto de prefijos y sufijos.[5]
La terminología de la química orgánica se encontraba en una situación muy diferente. Estas sustancias estaban formadas principalmente por un número pequeño de elementos, principalmente carbono e hidrógeno, en una gran variedad de proporciones. Al principio, Lavoisier utilizó la posición en el término de las raíces correspondientes al hidrógeno o al carbono para indicar la mayor o menor proporción de estos elementos en el compuesto. De este modo, estableció términos como oxide hydro-carboneux, oxide carbone hydrique o acide hydro-carbonique oxygéné. Sin embargo, este intento pronto se mostró inviable dada la variedad casi ilimitada de proporciones. El método binomial desarrollado en química inorgánica, que emplea las raíces de los elementos, no era adecuado para nombrar los nuevos compuestos que fueron aislándose, y más adelante, sintetizándose, con el desarrollo de la química orgánica.[5]
Desde nuestra perspectiva actual, podemos afirmar que para obtener una terminología sistemática de los compuestos orgánicos era necesario conocer lo que hoy denominamos fórmula empírica, fórmula molecular y estereoquímica de las moléculas orgánicas. Aunque todos estos conceptos no fueron suficientemente aclarados hasta las décadas finales del siglo XIX, resulta interesante emplearlos para obtener un esquema sencillo de los problemas que tenían planteados los químicos de este período.[5]
Para nombrar un compuesto como el sesquióxido de aluminio basta con conocer su fórmula empírica, la mínima proporción entre el número de átomos en el compuesto, en este caso, 2:3 de aluminio y oxígeno (sesqui- = 3/2 = tres átomos de oxígeno por cada dos de aluminio). Pero esto no ocurre así en los compuestos orgánicos. Además de conocer la proporción relativa de los diversos elementos en el compuesto, para nombrar las moléculas orgánicas como se realiza en la actualidad es necesario conocer lo que actualmente denominamos fórmula molecular. La proporción 1:1 - "CH" – de carbono e hidrógeno puede hacer referencia a compuestos tan diferentes como el benceno (C6H6) o el etino (C2H2). Del mismo modo, la fórmula empírica CH2 es perfectamente aplicable al etileno (C2H4) y sus polímeros y al ciclohexano (C6H12).
Una terminología basada únicamente en la fórmula empírica - con términos como el de "bicarburo de hidrógeno" propuesto por Faraday- no permitiría diferenciar entre los muchos compuestos orgánicos que tienen idénticas fórmulas empíricas. Para establecer fórmulas moleculares, los químicos de este período emplearon diversos métodos. En casos en los que era posible, se utilizaron determinadas reacciones con sustancias cuyas fórmulas eran conocidas como, por ejemplo, reacciones de neutralización entre bases inorgánicas y ácidos orgánicos. En otras ocasiones, el cálculo se efectuaba mediante la comparación de las densidades de los compuestos con la del hidrógeno, cuyo "peso atómico" era empleado como unidad. Ninguno de los métodos empleados estaba exento de problemas, lo que unido a las diversos valores de pesos atómicos empleados produjo una gran proliferación de fórmulas para un mismo compuesto.[5]
Pero la fórmula molecular tampoco basta. La distinción de las diversos compuestos orgánicos exige además un conocimiento de la estereoquímica de las moléculas. Siguiendo con el ejemplo anterior, resulta fácil comprobar que la fórmula molecular "C6H6" puede designar tanto al benceno como al hidrocarburo que hoy denominaríamos "2,4-hexadiino". Los problemas relacionados con la isomería son más importantes en otros grupos de compuestos. Por ejemplo, un sencillo cálculo permite mostrar que la fórmula C5H11OH corresponde a 8 isómeros espaciales diferentes. Si alargamos la cadena carbonada a 10 carbonos (C10H21OH) el número asciende a 507 y con 20 carbonos (C20H41OH) el número de isómeros llega a más de 5 millones. Tampoco una terminología basada solamente en la fórmula molecular podría reunir las características que consideramos necesarias en la actualidad para diferenciar estas sustancias.[5]
Con todos estos problemas, el proceso de normalización de la terminología de la química orgánica solo culminó con la Conferencia Internacional de Ginebra para la Reforma de la Nomenclatura Química, celebrada en 1892. Los treinta y cuatro participantes, representantes de diversos países europeos, concentraron todo su esfuerzo en la nomenclatura orgánica, la parte de la terminología química que más problemas presentaba.[5]
Entre las sesenta resoluciones adoptadas, una de las más importantes fue la adopción del sistema de nomenclatura «sustitutiva» para nombrar las diferentes clases de compuestos orgánicos. El nombre del compuesto se formaba mediante una raíz que indicaba la longitud de la cadena carbonada, considerada como la estructura base, a la que se añadían diversos sufijos y prefijos que indicaban las "sustituciones" en la molécula considerada como inicial. Actualmente la cadena carbonada se representa con la fórmula esqueletal. Se acordó el uso de los numerales griegos para designar la longitud de la cadena, con la excepción de los cuatro primeros que mantuvieron las raíces "met", "et", "prop" y "but". Para señalar las insaturaciones en la cadena carbonada se aprobó el empleo de los sufijos "-an", "-en" e "-in". También se acordaron criterios para indicar las ramificaciones y el empleo del prefijo "ciclo-" para designar las cadenas cíclicas. Una vez llegado a un acuerdo respecto al nombre de los derivados hidrocarbonados, el Congreso trató de alcanzar un consenso respecto a los sufijos y prefijos utilizados para designar los otros grupos de compuestos considerados como derivados de las correspondientes cadenas hidrocarbonadas. De este modo, se propuso el empleo del sufijo "-oxi" para designar a los éteres, "ácido -oico" para los ácidos carboxílicos, "-al" para los aldehídos, "-ona" para las cetonas y "-ol" para los alcoholes. Aunque se dedicó poco tiempo al estudio de los compuestos aromáticos, fruto de este congreso fue la adopción de los términos "benceno" y "naftaleno" y el uso de prefijos de origen griego como "orto-", "meta-" y "para-" y los localizadores "1" al "6" para designar las posiciones relativas de los derivados disustituidos del benceno, tal y como había sido propuesto anteriormente por William Körner (1839-1925) y August Kekulé (1829-1896). Las reglas de Ginebra de 1892, como más tarde se conocieron, pueden considerarse como la primera de las normalizaciones importantes de la terminología química orgánica.[5]
Principios de construcción nominal en química orgánica
[editar]El nombre de un compuesto es un término técnico que tiene como fin identificar un compuesto. Debe ser consistente con las reglas gramaticales (morfología, ortografía, semántica y sintaxis) del idioma de referencia.[5]
Cualidades de los nombres químicos
[editar]Un nombre químico orgánico debe presentar las siguientes cualidades:[5]
- Univocación: El nombre debe representar exacta y únicamente a ese compuesto. Cuando el nombre no corresponde a la estructura, se dice que el nombre es equívoco. Cuando el nombre corresponde al menos a dos compuestos posibles, se dice que el nombre es ambiguo. Cuando existen dos o más nombres que corresponden a un mismo compuesto, construidos por distintos principios, se denominan sinónimos. Un ejemplo son los nombres "Ácido α-aminoacético", "Ácido 2-aminoetanoico" y "Glicina". Véase también Fórmula esqueletal.
- Posibilidad: El nombre debe representar a una estructura congruente. La posibilidad formal es aquella que es permitida por la definición del compuesto. Ejemplo: 5-metilbutano no es un nombre formalmente posible, porque por definición el butano solo tiene 4 carbonos. La posibilidad material es aquella permitida por las propiedades físicas o químicas del compuesto. Ejemplo: 3,3,3-Tricloropentano no es un nombre materialmente posible debido a la tetravalencia del carbono.
- Convencionalidad: Si existen dos o más opciones unívocas y posibles de nombrar un compuesto por un sistema determinado de denominación, la IUPAC establece un acuerdo para nombrar solo una y descartar las demás. Ejemplo: El 1-Propanol se podría nombrar también como 3-propanol; sin embargo, la convención de la IUPAC establece que el nombre adecuado es el que conserva el número de posición más bajo.
- Simplificación: Si la estructura presenta un nombre unívoco, posible y convencional, pero existe la opción de eliminar descriptores debido a que no hay riesgo de ambigüedad, se elige dicha opción. Ejemplo: Se denomina “etanol” en vez de “1-etanol” porque no hay más opciones posibles no equivalentes, por lo que no es necesario el localizador de posición “1-“. Los sistemas de nomenclatura tienden a adoptar los casos que permiten mayor simplificación.
Tipos de nombres químicos
[editar]
Los nombres químicos se pueden clasificar también como sistemáticos, semisistemáticos y triviales.[6] Un caso especial son la siglas.
- Un nombre sistemático es aquel generado por un sistema general establecido por la IUPAC.[7] La nomenclatura sistemática de un compuesto orgánico general requiere la identificación y denominación de una estructura principal, denominada "compuesto padre" o "hidruro padre". Este nombre puede ser modificado por medio de prefijos, infijos, y sufijos, que transmiten con precisión los cambios estructurales necesarios para generar el compuesto derivado de la estructura principal. Los hidruros patrón pueden ser de átomos de nitrógeno, boro, silicio, etc. En química orgánica los compuestos padre son cadenas de hidrocarburo que pueden estar sustituidas por otros elementos o ramificaciones.[7]
- Un nombre semisistemático es aquel adoptado por una convención que utiliza compuestos con nombres triviales como esqueletos patrón, y sus derivados se denominan de manera sistemática a partir de dicho nombre.[6]
- Un nombre trivial, común, propio o vulgar es aquel que no está sometido a ninguna regla convencional de la IUPAC. Es generado por la persona que lo reportó con el fin de denominarlo de manera breve debido a que su mención continua, oral o escrita, con el nombre sistemático IUPAC puede resultar complicada o engorrosa.
- A veces se debe a razones históricas, los compuestos fueron nombrados antes de la creación de la IUPAC y las nomenclaturas sistemáticas: ácido fórmico, ácido acético, otros ácidos carboxílicos. Algunos nombres vulgares están ampliamente difundido en el habla coloquial: agua (H2O, oxidano), agua oxigenada (H2O2, dioxidano), sosa cáustica (NaOH, hidróxido de sodio), aspirina (ácido acetilsalicílico).
- Este tipo de nomenclatura se utiliza frecuentemente en la denomicación de compuestos complejos, especialmente en compuestos de interés industrial (estireno, anilina) o importancia científica (glicerol, glucosa, ciclopamina y muchos otros compuestos naturales). Sus nombres propios pueden usarse como nombre padre para sus derivados en una nomenclatura semi-sistemática. A su vez sus derivados (como todo compuesto) también pueden tener nombre propio. Ejemplos: benceno: nitrobenceno, diclorobenceno; bencenol o fenol: 2-isopropil-5-metilfenol o timol, metilfenol o crisol; metilbenceno o tolueno: dinitrotolueno, 2,4,6-trinitrotolueno.
- Las siglas: son un proceso de creación de palabras a partir de cada grafema inicial de los términos principales de una expresión compleja.[9] Por lo general se utilizan las primeras letras en mayúscula de las palabras del nombre. Existen compuestos de mención común en bioquímica o síntesis orgánica que se mencionan por sus siglas en inglés.
- Ejemplos:
- ADN (ácido desoxirribonucleico)
- ATP (adenosín trifosfato)
- DIBAL-H (Hidruro de diisobutilaluminio, en inglés DiIsoButylALuminium Hydride)
- LDA (Diisopropilamiduro de litio, en inglés Lithium DiisopropylAmide)
- TOSMIC (Isocianuro de toluensulfonilmetilo, en inglés TOlueneSulfonylMethyl IsoCyanide)
- PGAL (Gliceraldehído-3-fosfato, en inglés 3-PhosphoGlycericALdehyde)
Numeración
[editar]La numeración de un compuesto patrón es la acción de asignar una serie de números desde un principio y fin establecidos por convención.[7] Cada número asignado por átomo representa la posición de ese átomo con respecto a la estructura del compuesto patrón. A continuación se muestra un ejemplo:

Hidrógeno indicado
[editar]En algunos sistemas cíclicos con el máximo número de dobles ligaduras conjugadas con nombres triviales en donde son posibles dos isómeros con un carbono sp3, se requiere indicar el sitio saturado con una "H" en cursiva (Hidrógeno indicado).

Puntuación
[editar]La puntuación en los nombres químicos es de gran importancia, especialmente para evitar confusión en la construcción de la estructura del compuesto. Los signos de puntuación más comunes en la nomenclatura orgánica son:[10]
1. Las comas (,) se utilizan para:[10]
- a) Separar números o letras referidos en una serie de posiciones en la estructura. Por ejemplo: 1,2,2-Tricloroetano. Otro ejemplo es N,N-Dietil-2-furamida.
- b) Para separar letras o sus combinaciones que indican sitios de fusión en los nombres de los sistemas de anillos fusionados.
Ejemplo: Dibenzo[a,j]antraceno.
2. Los paréntesis (( )) se utilizan para:[11]
- a) Separar nombres de sustituyentes que a su vez contienen otros sustituyentes. Ejemplo: 3-(6-cloro-1-naftil)-1-octanol.
- b) Indicar descriptores estereogénicos. Ejemplos: (2R)-2-fluorobutano y (Z)-2-Buteno
- c) Indicar posiciones de conexiones de los hiperátomos en la nomenclatura de ciclofanos. Ejemplo: 1,3,5(2,5)tribencenaciclohexafano.
3. Los guiones (-) sirven para separar:[10]
- (a) Números de posición de palabras o sílabas en un nombre. Por ejemplo: 2-Cloro-3-hidroxi-4-metilpentanal.
- (b) Números de posición referentes a distintas partes de un nombre (aunque se prefiere insertar paréntesis). Un ejemplo ilustrativo es N-Acetil-N-(2-naftil)benzamida (Se prefiere a N-Acetil-N-2-naftilbenzamida)
- (c) Las dos partes en la designación de un sitio de fusión primaria en un nombre generado por un sistema de nomenclatura de fusión. Ejemplo: Tieno[3,2-b]furano.
- (d) Un descriptor estereogénico de un nombre. Ejemplos: (E)-2-Buteno y (2R)-2-fluorobutano.
Después de un paréntesis se coloca guion únicamente si un número de posición aparece al final del paréntesis, por ejemplo 3-(bromocarbonil)-4-(clorocarbonil)-2-metilbenzamida.
4. Los dos puntos (:) sirven para separar conjuntos relacionados de números de posición cuando se ya se utilizaron comas. Algunos ejemplos ilustrativos son:[10]
- 1,4,5,8-Tetrahidro-1,4:5,8-dimetanoantraceno
- Benzo[1",2":3,4:4",5":3',4']diciclobuta[1,2-b:1',2'-c']difurano
- 1,1':2',1"-Terciclopropano
5. El punto (.) se utiliza para separar números indicadores de tamaño de anillo en los nombres construidos según el sistema de von Baeyer y en los nombres de los compuestos espiro. Algunos ejemplos son el biciclo[3.2.1]octano y el 6-oxaspiro[4.5]decano.[10]
6. Los corchetes ([ ]) se utilizan para:[11]
- a) Agrupar los números de tamaño de ciclo en la nomenclatura de von Baeyer y de los compuestos espiro. Algunos ejemplos son el biciclo[3.2.1]octano y el 6-oxaspiro[4.5]decano.
- b) Indicar operaciones de fusión en la nomenclatura de fusión. Por ejemplo, Tieno[3,2-b]furano.
- c) Agrupar sustituyentes ya indicados con paréntesis. Por ejemplo 3-[1-(4-clorofenil)etil]octanal.
7. Las llaves ({ }) agrupan sustituyentes que contienen otros sustituyentes ya descritos por corchetes.[11]
Ejemplo: Ácido (2-{1-[2-(3-clorofenil)etoxi]etil}ciclopropil)etanoico.
8. Los espacios se utilizan solo en nomenclatura radicofuncional para separar palabras. Todos los demás sistemas requieren guiones para indicar los descriptores.[10]
Ejemplos: Ácido palmítico, metil etil éter, acetato de etilo, éster etílico del ácido malónico, cetal metílico de la butanona, cianuro de vinilo.
Sistemas de nomenclatura
[editar]Un sistema de nomenclatura consiste en una serie de procedimientos en el cual se toma como referencia un compuesto patrón y por medio de descriptores de modificación de estructura, composición o conectividad se define el nombre del compuesto. Dichos descriptores pueden presentarse en el nombre como lexemas, sufijos, prefijos, infijos, números o letras griegas. Los sistemas más comunes de nomenclatura son:
Nomenclatura de sustitución
[editar]La nomenclatura sustitutiva implica el intercambio de uno o más átomos de hidrógeno por otro átomo o grupo.[12]

Un sustituyente es una partición molecular (es decir, no representa a una unidad molecular ni a un compuesto) que tiene uno (univalente) o varios (multivalente) enlaces libres, disponibles para una operación de intercambio de hidrógeno. Ejemplos de sustituyentes son el metilo (CH3—), etilo (CH3-CH2—), carboxilo (HOOC—) o el 2-hidroxipropilo (CH3-CH(OH)-CH2—). En muchas ocasiones, cuando la sustitución se lleva a cabo por átomos en determinado patrón de conectividad, se denominan grupos funcionales y éstos pueden ser denominados reemplazando el sufijo del hidruro padre por un sufijo funcional. A continuación se ilustra un ejemplo:

Nomenclatura radicofuncional
[editar]La nomenclatura radicofuncional considera dos especies químicas: una equivalente a un anión y otra equivalente a un catión o un sustituyente (no necesariamente se encuentran enlazados iónicamente en el compuesto; solo es una construcción hipotética). La especie tipo anión se nombra primero como sustantivo y el catión (o sustituyente) se nombra como adjetivo (utilizándose el sufijo “-ico”) o se adjetiva con la preposición “de”:[6]

Nomenclatura de reemplazo
[editar]La nomenclatura de reemplazo implica el intercambio de un átomo de carbono por un heteroátomo. Se utilizan sobre todo:[13]
- - prefijos especiales relacionados con el átomo a reemplazar, que por regla general terminan en “a”,
- - números que indican la posición del átomo reemplazado.
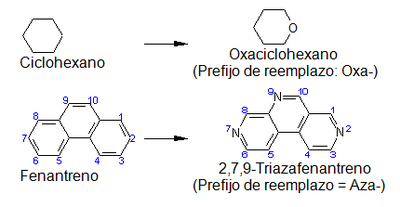
También se puede utilizar nomenclatura de reemplazo para el oxígeno. En este caso, se utilizan infijos que terminan en “-o-“.

Nomenclatura aditiva
[editar]El sistema de nomenclatura aditiva es utilizada por lo general en compuestos patrón insaturados, aromáticos o con pares libres; los compuestos se nombran como derivados de adición (Por lo general de hidrógeno) sobre las insaturaciones o los pares libres. Pueden utilizarse la numeración posicional, prefijos o infijos de adición.[14]

Nomenclatura multiplicativa
[editar]La nomenclatura multiplicativa se utiliza cuando dos o más unidades repetidas, ya sean simples o complejas, se conectan por medio de un grupo o átomo. En este caso se utilizan numerales de posición para indicar el sitio de conexión, se menciona el átomo o grupo vinculante (Puente), prefijos de multiplicidad, localizadores (distinguidos por apóstrofos, el número con apóstrofo se denomina primado) y el nombre de la unidad repetida como compuesto (no como sustituyente).[15]

Sistemas especiales de nomenclatura
[editar]Los sistemas especiales de nomenclatura se establecieron para nombrar compuestos orgánicos cuyos esqueletos tienen un grado de complejidad mayor a los sistemas acíclicos y monocíclicos y requieren consideraciones especiales. La estereoquímica de los esqueletos también genera descriptores especiales en los nombres de los compuestos.
1. Sistema de nomenclatura de fusión: Un compuesto de fusión considera dos sistemas cíclicos que comparten un enlace covalente. Este sistema establece definiciones y descriptores para los tipos de fusión, la orientación, cantidad y tipo de anillos fusionados, numeración, sustituyentes y nombres triviales.[16]

2. Sistema de nomenclatura de von Baeyer: Un nombre de von Baeyer se genera cuando a un compuesto monocíclico se le añade una cadena lateral de carbono que se vuelve a conectar en el monociclo para formar un nuevo compuesto bicíclico. El fundamento es la definición y descripción de los carbonos de conexión (Cabezas de puente) y los carbonos que forman cada ciclo (Carbonos puente).[17] Un ejemplo es el siguiente compuesto:

Según el sistema von Baeyer, este compuesto se denomina 1,7,7-trimetilbiciclo[2.2.1]heptano (En la nomenclatura semisitemática de monoterpenos, este compuesto se llama bornano)
3. Sistema de nomenclatura de Hantzsch-Widman: Un compuesto heterocíclico es aquel que forma una estructura cíclica en la cual al menos uno de los átomos que la conforman no es carbono. Este sistema genera nombres para compuestos monoheterocíclicos patrón de no más de 10 miembros. Los descriptores surgen a partir del tipo y cantidad de heteroátomos, saturación y número de miembros del ciclo.[18] Un ejemplo es el siguiente compuesto:

Según la nomenclatura Hantzsch-Widman, este compuesto se denomina Oxolano (La nomenclatura de adición lo denomina tetrahidrofurano)
4. Sistema de nomenclatura de ciclofanos: Un ciclofano es un compuesto policíclico que consiste en un sistema de dos o más ciclos unidos por dos o más cadenas que los conectan en carbonos diferentes. El principio es visualizar al ciclofano como un hiperciclo y a cada ciclo incluido como un hiperátomo.[19]

5. Sistema de nomenclatura de iones y radicales: Esta nomenclatura define cómo nombrar especies con electrones no apareados (Radicales libres),[20] cargadas negativa[21] (Aniones) o positivamente[22] (Cationes).
6. Sistema de nomenclatura estereoquímica: Este sistema define descriptores para nombrar propiedades geométricas y estereoquímicas que distinguen a los compuestos por su configuración. Se encuentran incluidos el sistema cis-trans, el sistema de Cahn-Ingold-Prelog y el sistema D-L.[23]
7. Sistemas de nomenclatura de productos naturales: La mayoría de los productos naturales tienen sus nombres a partir de nombres triviales de estructuras base, y se establecen descriptores especiales, tales como numeración, operaciones estructurales (Sustitución, reemplazo, adición, homologación, eliminación, ciclación, contracción o expansión de anillo), polimerización o estereoquímica.[24]
Existen diversas convenciones que establecen compuestos patrón con nombres triviales, tales como los sistemas de nomenclatura de sacáridos, ácidos grasos, esfingolípidos, nucleótidos, terpenos, esteroides, carotenos, tetrapirroles, flavonoides, alcaloides y aminoácidos.
Véase también
[editar]- Nomenclatura de hidrocarburos acíclicos
- Nomenclatura de hidrocarburos monocíclicos
- Nomenclatura de agrupaciones de ciclos
- Nomenclatura de ciclofanos
- Nomenclatura de iones y radicales
- Nomenclatura de fusión
- Nomenclatura de von Baeyer
- Nomenclatura de compuestos heterocíclicos
- Nomenclatura de funciones orgánicas con oxígeno
- Nomenclatura de funciones orgánicas con nitrógeno
- Nomenclatura organometálica
- Nomenclatura de productos naturales
- Nomenclatura de polímeros
- Reglas de Cahn-Ingold-Prelog
- Isomería cis-trans
- Nomenclatura D-L
- Grupo funcional
Referencias
[editar]- ↑ International Union of Pure and Applied Chemistry, Organic Chemistry Deividson, Commission on Nomenclature of Organic Chemistry, Nomenclature of Organic Chemistry, Sections A, B, C, D, E, F, and H, 2012 Edition, J. Rigaudy and S. Klesney, eds, Pergamon Press, Oxford, 1979, 559 pp.
- ↑ IUPAC Nomenclature of Organic Chemistry. Section A, B, C, D, F and H. London: Butterworth, 1979. (Existe traducción castellana, Madrid: CSIC, 1987 y traducción catalana, Barcelona: Institut d’Estudis Catalans, 1988).
- ↑ Preamble
- ↑ Anderson, E.; Veith, G.D; Weininger, D. (1987) SMILES: A line notation and computerized interpreter for chemical structures. Report No. EPA/600/M-87/021. U.S. EPA, Environmental Research Laboratory-Duluth, Duluth, MN 55804
- ↑ a b c d e f g h i García Belmar, A.; Bertomeu Sánchez, J.R. "Lenguaje, ciencia e historia: Una introducción histórica a la terminología química.", en Alambique, 17 (1998), 20-37. Consultado al 2 de junio de 2011
- ↑ a b c R-0.2.3 Names
- ↑ a b c R-1.0 Introduction [1]
- ↑ Wall, Monroe E., M. C. Wani, C. E. Cook, K. H. Palmer, A. T. McPhail, and G. A. Sim, “Plant antitumor agents. 1. The isolation and structure of camptothecin, a novel alkaloidal leukemia and tumor inhibitor from Camptotheca acuminata” Journal of the American Chemical Society, 88 (1966), 3888-3890.
- ↑ Pedro Álvarez de Miranda (UAM) Acrónimos, acronimia: revisión de un concepto en Cervantes virtual.
- ↑ a b c d e f R-0.1.3 Punctuation
- ↑ a b c R-0.1.5 Enclosing marks
- ↑ R-1.2.1 Substitutive operation
- ↑ R-1.2.2 Replacement operation
- ↑ R-1.2.3 Additive operation
- ↑ R-1.2.8 Multiplicative operation
- ↑ R-2.4.1 Fusion nomenclature
- ↑ R-2.4.2 Bridged parent hydrides - extension of the von Baeyer system
- ↑ Rule B-1. Extension of Hantzsch-Widman System
- ↑ Part I: Phane Parent Names
- ↑ R-5.8.1 Radicals
- ↑ R-5.8.3 Anions
- ↑ R-5.8.2 Cations
- ↑ «Stereochemistry». Archivado desde el original el 31 de enero de 2012. Consultado el 1 de junio de 2011.
- ↑ Revised Section F: Natural Products and Related Compounds



