Radiactividad ambiental
La radiactividad ambiental se produce por los materiales radiactivos que se encuentran en el entorno humano. Mientras que algunos radioisótopos, como el estroncio 90 (90Sr) y el tecnecio 99 (99Tc), solo existen en la Tierra como resultado de la actividad humana, y otros, como el potasio 40 (40K), solo se produce por procesos naturales, algunos isótopos, como el tritio (3H), se deben tanto a procesos naturales como a actividades humanas. La concentración y ubicación de algunos isótopos naturales, en particular del uranio 238 (238U), pueden verse afectadas por la actividad humana.
Niveles en el suelo
[editar]La radiactividad está presente en todas partes, y lo ha estado desde la formación de la tierra. Según el OIEA, los suelos suelen contener los siguientes radioisótopos naturales: 40K, 226Ra, 238U y 232Th. En un kg de tierra, el potasio 40 representa de media 370 Bq de radiación, y cada uno de los otros contribuye con una media de 25 Bq.[1] Algunos suelos pueden presentar grandes variaciones de estos promedios.
Sedimentos marítimos y fluviales
[editar]Un reciente informe sobre el río Sava de Serbia sugiere que muchos de los sedimentos fluviales contienen alrededor de 100 Bq kg-1 de radioisótopos naturales (226Ra, 232Th y 238U).[2] Según Naciones Unidas, la concentración normal de uranio en los suelos oscila entre 300 μg kg-1 y 11.7 mg kg-1.[3] Es bien conocido el hecho de que ciertas plantas, llamadas hiperacumuladores, son capaces de absorber y concentrar metales en sus tejidos. El yodo se aisló en Francia por primera vez en algas, lo que sugiere que las algas son hiperacumuladores de yodo.
Los radioisótopos también pueden detectarse en el limo. Busby cita un informe de Garland y otros (1989) sobre la actividad del plutonio en los sedimentos en Gales, lo que sugiere que cuanto más cerca de Sellafield está un lugar, más alta es la concentración de plutonio en el limo.
Obra humana
[editar]
La radiactividad adicional en la biosfera causada por la actividad humana debido a las emisiones de radiactividad inducida por el hombre y a los subproductos radiactivos, puede clasificarse en varios tipos.
- Emisiones normales autorizadas, que ocurren durante la actividad habitual de una planta o proceso en el que intervengan materiales radiactivos artificiales.
- Por ejemplo, la emisión de 99Tc que se produce en el departamento de medicina nuclear de un hospital cuando un paciente a quien se ha hecho un escáner elimina el agente.
- Emisiones de materiales radiactivos artificiales que suceden durante un accidente industrial o de investigación.
- Por ejemplo, el accidente de Chernóbil.
- Emisiones resultantes de la actividad militar.
- Por ejemplo, las pruebas de armas nucleares.
- Emisiones resultantes de un delito.
- Por ejemplo, el accidente de Goiânia, en el que unos ladrones robaron varios equipos médicos, desconociendo su contenido radiactivo, lo que tuvo como consecuencia que numerosas personas quedaran expuestas a la radiación.
- Emisiones de subproductos radiactivos resultantes de la minería, etc.
- Por ejemplo, la emisión de trazas de uranio y torio del carbón quemado en las centrales térmicas.
Agricultura y transmisión de radiactividad a humanos
[editar]El hecho de que un radioisótopo se encuentre en la superficie terrestre no significa que vaya a entrar en la cadena alimenticia humana. Los materiales radiactivos que se encuentran en el medio ambiente pueden llegar a los humanos por distintas vías, y es la química del elemento la que suele marcar la vía más probable.

Ganado
[editar]En su libro «Radiactividad, radiación ionizante y energía nuclear»,[4] Jiří Hála afirma que el ganado solo transmite una mínima parte del estroncio, cesio, plutonio y americio que ingieren a los humanos que consumen leche y carne. Tomando el ejemplo de la leche, si una vaca ingiere diariamente 1 000 Bq de los isótopos mencionados, su leche presentará las siguientes cantidades:
- 90Sr: 2 Bq dm−3
- 137Cs: 5 Bq dm−3
- 239Pu: 0,001 Bq dm−3
- 241Am: 0,001 Bq dm−3
Suelos
[editar]Jiří Hála afirma en su libro que existen grandes variaciones en la capacidad que presentan los distintos tipos de suelo para absorber radioisótopos. Las partículas de arcilla y los ácidos húmicos pueden alterar la distribución de los isótopos entre el suelo y el agua que contiene. El coeficiente de distribución Kd es la relación entre la radiactividad del suelo (Bq g−1) y la del agua que contiene (Bq ml−1). Si la radiactividad está firmemente fijada por los minerales del suelo, las plantas y pastos que crecen en dicho suelo absorberán menos radiactividad
Prueba Trinity
[editar]
Una gran fuente de radiactividad artificial son las pruebas de armas nucleares. Los cristales de trinitita formados por la primera bomba atómica contienen radioisótopos producidos por la activación neutrónica y la fisión nuclear. Además, hay varios isótopos naturales presentes. Un reciente artículo[5] expone los niveles de radioisótopos de vida larga en la trinitita. La trinitita está formada por feldespato y cuarzo fundidos a resultas del calor producido por la explosión. Se utilizaron dos muestras de trinitita, la primera extraída a una distancia entre 40 y 65 m de la zona cero y la segunda de una zona más alejada.
Productos de activación
[editar]La acción de los neutrones sobre los isótopos estables pueden originar radioisótopos: por ejemplo, el bombardeo de neutrones (activación neutrónica) del nitrógeno-14 forma carbono-14. Este radioisótopo puede proceder del ciclo del combustible nuclear; es el radioisótopo responsable de la mayor parte de dosis experimentadas por la población que resultan de las actividades del sector de la energía nuclear.
Las pruebas de bombas nucleares han incrementado la actividad específica del carbono, mientras que el uso de combustibles fósiles la ha reducido. Para más detalles, véase el artículo sobre datación por radiocarbono.
Productos de la fisión
[editar]Las emisiones de las plantas nucleares producidas durante el ciclo del combustible nuclear introducen productos de la fisión en el medio ambiente. Las emisiones de las plantas de reprocesamiento nuclear suelen ser de radioisótopos de vida media o larga, consecuencia de que se deje enfriar el combustible nuclear durante varios años antes de disolverlo en ácido nítrico. Las emanaciones producidas en los accidentes de un reactor nuclear o la detonación de una bomba contienen una mayor cantidad de radioisótopos de vida corta (cantidades expresadas en Bq).
Vida corta
[editar]
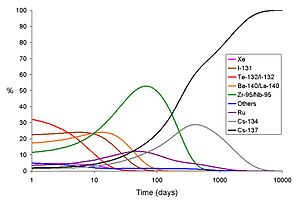
Un ejemplo de producto de fisión de vida corta es el yodo-131, que también puede formarse como producto de la activación neutrónica del telurio.
Tanto en las emisiones de una bomba como en las emanaciones de un accidente de un reactor nuclear, los isótopos de vida corta causan que el índice de las dosis sea mucho más alto el primer día que en días muy posteriores, fenómeno que se produce aunque no se intente descontaminar la zona. En los gráficos a la derecha se muestran el índice total de rayos gamma y la proporción de cada isótopo emitido en el accidente de Chernóbil.
Vida media
[editar]Un ejemplo de vida media es el 137Cs, cuyo periodo de semidesintegración es de 30 años. El cesio se encuentra en las emisiones de una bomba nuclear y en el ciclo del combustible nuclear. Según un artículo sobre la radiactividad encontrada en las ostras del Mar de Irlanda, en la espectroscopía gamma se apreciaron trazas de 141Ce, 144Ce, 103Ru, 106Ru, 137Cs, 95Zr and 95Nb. También se encontró el producto de activación 65Zn, se cree que procedente de la corrosión del revestimiento de magnox de los estanques de refrigeración.[6] Es probable que las emisiones actuales de todos estos isótopos de la planta de reprocesamiento de Sellafield sean menores.
Una importante parte de las emanaciones de Chernóbil estaban compuestas por cesio-137, responsable de la exposición externa a largo plazo (al menos un año después del incendio) que se produjo en el lugar. Los isótopos de cesio en las emanaciones han tenido un fuerte efecto en la agricultura [2].
En el accidente de Goiânia se emitió una gran cantidad de cesio, al sustraerse una fuente radiactiva de uso médico que después se abrió a golpes con la intención de convertirla en chatarra. El accidente podría haberse evitado en varios momentos: los últimos dueños legales no depositaron la fuente en un lugar seguro, y los trabajadores que procesaron la chatarra no reconocieron los símbolos que la marcaban como objeto radiactivo.
Un informe de Soudek y otros (2006) detalla la absorción de 90Sr y 137Cs en girasoles procedentes de cultivos hidropónicos.[7] Se encontró cesio en las nervaduras de las hojas, en el tallo y en las hojas apicales. Según el informe, un 12% del cesio y un 20% del estroncio entraron en la planta. Este informe también explica el efecto del potasio, el amonio y el calcio en la absorción de radioisótopos.
El cesio de fija firmemente en minerales arcillosos como la illita y la montmorillonita, así permanece en las capas superiores del suelo, desde donde puede ser absorbido por plantas de raíz poco profunda. Es así como las gramíneas y las setas pueden presentar una considerable cantidad de 137Cs que puede pasar a los humanos a través de la cadena alimentaria. Una medida efectiva para reducir los niveles de 137Cs es labrar el suelo en profundidad. Con ello se consigue que el 137Cs quede fuera del alcance de las raíces poco profundas de las gramíneas, lo que en consecuencia reducirá el nivel de radiactividad del pasto. Después de una guerra nuclear o un accidente grave, eliminar los centímetros superiores de un suelo y enterrarlos en una zanja reduce la dosis de rayos gamma a largo plazo procedentes del 137Cs en los humanos porque se atenuarán los protones a su paso por el suelo. Cuanto más profunda sea la zanja y más lejos se encuentre de los asentamientos humanos, mejor será el nivel de protección de la población.
En la ganadería, una buena forma de reducir la presencia de 137Cs es darle a los animales una pequeña cantidad de azul de Prusia. Este cianuro de hierro y potasio actúa como un intercambiador de iones. El cianuro está tan firmemente enlazado al hierro que un humano puede ingerir varios gramos de azul de Prusia al día sin peligro. El azul de Prusia reduce la semivida biológica del cesio (no confundir con el periodo de semidesintegración). El periodo de semidesintegración del 137Cs ronda los 30 años, es una constante y no puede cambiarse. No obstante, la semivida biológica puede cambiar según la naturaleza y costumbres del organismo en cuestión. El cesio en humanos suele tener una semivida de entre uno y cuatro meses. Otra ventaja del azul de Prusia es que el cesio depositado en las heces de los animales se encuentra en una forma que las plantas no pueden asimilar, lo que evita que el cesio pueda reciclarse. Para el tratamiento de humanos o animales es necesario un azul de Prusia de una graduación concreta. Los intentos de utilizar el pigmento que se usa en las pinturas no han tenido éxito.
Vida larga
[editar]Ejemplos de isótopos de vida larga son el yodo-129 y el tecnecio-99, que tienen, respectivamente, periodos de semidesintegración de 15 millones y 200 000 años.
Plutonio y otros actínidos
[editar]En la cultura popular, se considera al plutonio como la mayor amenaza a la vida, pero es falso: aunque obviamente la ingesta de plutonio no es buena para la salud, otros radioisótopos como el radio son más tóxicos para los humanos. De todas formas, siempre que sea posible debe evitarse la introducción de elementos transuránicos como el plutonio en el medio ambiente. Actualmente, las labores del reprocesamiento nuclear están en el centro de una fuerte polémica, ya que los que se oponen a esta actividad temen que no haya suficiente control sobre grandes cantidades de plutonio, y puedan liberarse en el medio ambiente.
En el pasado, una de las grandes fuentes de liberación de plutonio al medio ambiente han sido las pruebas de armas nucleares.
- Las pruebas en el aire diseminaron plutonio por toda la Tierra. La dilución del plutonio ha tenido como resultado que el riesgo debido a la exposición sea pequeño, ya que cada persona solo se expone a una mínima cantidad.
- Las pruebas subterráneas tienden a formar roca fundida, que se enfría rápidamente, sellando los actínidos en su interior e impidiendo su movimiento. De nuevo el peligro para los humanos es muy pequeño, a no ser que se cave en el lugar de la prueba.
- Las pruebas de seguridad en los simulacros de accidente plantean la mayor amenaza para las personas. Algunos terrenos utilizados para estos experimentos (realizados al aire libre) no se han abierto al uso general a pesar de que en algún caso se haya llevado a cabo una descontaminación intensiva.
Radiactividad natural
[editar]Productos de activación de rayos cósmicos
[editar]Los isótopos cosmogénicos (o núclidos cosmogénicos) son isótopos creados cuando un rayo cósmico de alta energía interactúa con el núcleo de un átomo del sistema solar. Estos isótopos se producen en materiales terrestres como rocas o elementos de la atmósfera terrestre, y en entes extraterrestres como los meteoritos. La medición de los isótopos cosmogénicos ofrece importantes datos sobre numerosos procesos geológicos y astronómicos.
Entre los isótopos cosmogénicos existen tanto isótopos estables como isótopos radiactivos, entre ellos el tritio, el carbono-14 y el fósforo-32.
Modos de producción
[editar]La siguiente es una lista de radioisótopos formados por la acción de los rayos cósmicos en la atmósfera, incluyendo la forma de producción de cada isótopo (Datos obtenidos del informe SCOPE50, capítulo 1, tabla 1.9).
| Isótopo | Modo de formación |
|---|---|
| ³H (Tritio) | 14N (n, 12C)³H |
| 7Be | Espalación (N and O) |
| 10Be | Espalación (N y O) |
| 11C | Espalación (N y O) |
| 14C | 14N (n, p) 14C |
| 18F | 18O (p, n)18F y espalación (Ar) |
| 22Na | Espalación (Ar) |
| 24Na | Espalación (Ar) |
| 28Mg | Espalación (Ar) |
| 31Si | Espalación (Ar) |
| 32Si | Espalación (Ar) |
| 32P | Espalación (Ar) |
| 34mCl | Espalación (Ar) |
| 35S | Espalación (Ar) |
| 36Cl | 35Cl (n, )36Cl |
| 37Ar | 37Cl (p, n)37Ar |
| 38Cl | Espalación (Ar) |
| 39Ar | 38Ar (n, )39Ar |
| 39Cl | 40Ar (n, np)39Cl y espalación (Ar) |
| 41Ar | 40Ar (n, )41Ar |
| 81Kr | 80Kr (n, ) 81Kr |
Trasmisión a la tierra
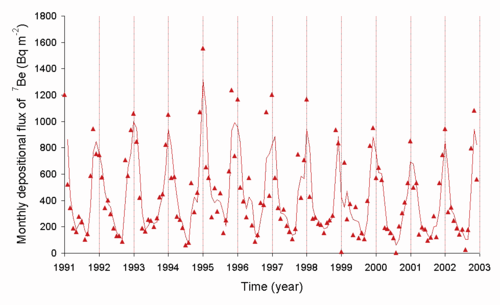
[editar]El nivel de berilio-7 en el aire está relacionado con el ciclo de las manchas solares, ya que este radioisótopo se forma en la atmósfera gracias a la radiación solar. La velocidad a la que se transfiere del aire al suelo depende en parte de las condiciones climáticas.
Aplicaciones de cada isótopo en geología
[editar]| Elemento | Masa | Semivida (años) | Aplicación |
|---|---|---|---|
| Helio | 3 | - estable - | datación de la exposición de rocas de olivino |
| Berilio | 10 | 1,36 millones | datación de la exposición de rocas y sedimentos de cuarzo, datación de masas heladas, medida de índices de erosión |
| Carbono | 14 | 5 730 | datación de material orgánica y agua |
| Neón | 21 | - estable - | datación de superficies muy estables y de larga exposición, incluyendo meteoritos |
| Aluminio | 26 | 720 000 | datación de la exposición de rocas y sedimentos |
| Cloro | 36 | 308 000 | datación de la exposición de rocas y aguas subterráneas |
| Calcio | 41 | 103 000 | datación de la exposición de rocas carbonatadas |
| Yodo | 129 | 15,7 millones | indicador de aguas subterráneas |
Aplicaciones de la datación
[editar]Como los isótopos cosmogénicos tienen largos periodos de semidesintegración (entre miles y millones de años), son útiles para la datación radiométrica en geología. Los isótopos cosmogénicos se producen en la superficie de la Tierra o cerca de ella, y por tanto su aplicación principal es la datación de edades e índices de procesos geomórficos y sedimentarios.
Estas son algunas aplicaciones específicas de isótopos cosmogénicos:
- Datación de la exposición de superficies terrestres, como rocas madre arrastradas por glaciares, escarpes de fallas o detritus de corrimientos de tierras
- Datación del soterramiento de sedimentos, rocas madre y hielo
- Medida de índices estables de erosión
- Datación absoluta de materia orgánica (datación por radiocarbono)
- Datación absoluta de masas acuosas, medida de los índices de transportación de aguas subterráneas
- Datación absoluta de meteoritos y superficies lunares
Referencias
[editar]- ↑ Generic Procedures for Assessment and Response during a Radiological Emergency, OIEA, serieTECDOC, n° 1162, poblicado en 2000 [1]
- ↑ Z. Vukovic, V. Sipka, D. Todorovic y S. Stankovic, Journal of Radioanalytical and Nuclear Chemistry, 2006, 268, p. 129–131.
- ↑ Comité Científico de Naciones Unidas sobre los Efectos de la Radiación Atómica, 1993, Informe a la Asamblea General con anexos científicos, Nueva York
- ↑
- ↑ P.P. Parekh, T.M. Semkow, M.A. Torres, D.K. Haines, J.M. Cooper, P.M. Rosenberg y M.E. Kitto, Journal of Environmental Radioactivity, 2006, 85, pp. 103-120
- ↑ A. Preston, J.W.R. Dutton y B.R. Harvey, Nature, 1968, 218, pp. 689-690.
- ↑ P. Soudek, Š. Valenová, Z. Vavříková y T. Vaněk, Journal of Environmental Radioactivity, 2006, 88, pp. 236-250
Enlaces externos
[editar]- Purdue University Prime Lab, "Cosmogenic nuclides" Archivado el 6 de junio de 2011 en Wayback Machine.
- "Cosmogenic Exposure Dating and the Age of the Earth"
- Cosmogenic Isotope Laboratory, University of Washington
- Esta obra contiene una traducción derivada de «Environmental radioactivity» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.