Securinina
| Securinina | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| 9,10,11,11a-Tetrahidro-8H-6,11b-metanofuro[2,3-c]pirido[1,2-a]piridoazepin-2(6H)-ona | ||
| General | ||
| Otros nombres | Virosecurinina | |
| Fórmula estructural |
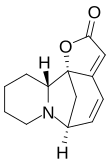 | |
| Fórmula molecular | C13H15NO2 | |
| Identificadores | ||
| Número CAS | 5610-40-2[1] | |
| ChEBI | 9079 | |
| ChEMBL | CHEMBL303062 | |
| ChemSpider | 391181 | |
| UNII | G4VS580P5E | |
| KEGG | C10614 | |
| Propiedades físicas | ||
| Apariencia | Cristales amarillos | |
| Masa molar | 217,267 g/mol | |
| Punto de fusión | 142,5 °C (416 K) | |
| Propiedades químicas | ||
| Acidez | 7.17 pKa | |
| Solubilidad en agua | Soluble en etanol, cloroformo, es más difícil en acetona y difícil de disolver en agua. | |
| Riesgos | ||
| Riesgos principales | LD50=(mus, orl) 270 mg/kg | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||

La securinina es un alcaloide derivado de la fenilalanina aislado por primera vez por Mukherjee en 1964 a partir de las hojas, raíces y tallos Securinega suffruticosa y Phyllanthus discoides(Euphorbiaceae). También se ha encontrado en Securinega durissima, Securinega fluggeoides y en la corteza de Securidaca longepedunculata (Fabaceae).
Actividad biológica
[editar]Es un antagonista estereospecífico del receptor GABA. Es estimulante del sistema nervioso central con actividad similar a la estricnina pero de menor toxicidad. Causa estimulación respiratoria, aumenta el tono muscular e hipotensión.
Derivados
[editar]- 14,15-Dihidrosecurinina: Encontrado en Securinega suffruticosa (Euphorbiaceae); CAS 1878-04-2; pKa = 8.35; PF = 59 °C
- 14,15-Dihidro-15α-metoxisecurinina (Secuamamina C) Aislado de la corteza de Securinega suffruticosa var. amamiensis. CAS: 1004529-77-4. Fórmula molecular: C14H19NO3. Sólido amorfo. [α]25D = +82.1 ( c, 0.15 in CHCl3). UV: [neutral]λmax232 (log ε3.41) ;283 (log ε2.53) (MeOH).
Biosíntesis
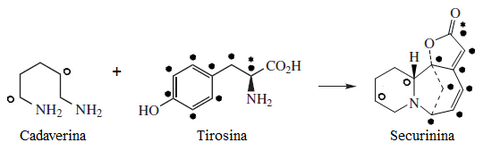
[editar]Sankawa y colaboradores dedujeron que la securinina puede provenir de una molécula de tirosina y otra de cadaverina. Los precursores lisina, cadaverina, y tirosina fueron los que mostraron mayor incorporación. Los experimentos de degradación revelaron que la [1,5-14C]-cadaverina marcó específicamente el anillo de piperidina de securinina y la radioactividad de DL-tirosina-[2-14C] fue incorporado en el carbonilo C-11 de la lactona. Los experimentos con L-tirosina[U-14C] y L-tirosina-[3’,5’-3H;U-14C] prueba que el fragmento C6 – C2 es derivado del anillo aromático y los carbono C-2 y C-3 de la tirosina. [2]
Propiedades espectroscópicas
[editar]Síntesis
[editar]Síntesis de Honda:[3] Parte de la 2-acetilpiridina y el anhídrido sórbico. Consta de los siguientes pasos:
- (a) Preparación del éster vinílico (2E,4E)-hexa-2,4-dienoato de (1-(piridin-2-il)etenilo) con formación del enolato con una base (LiN(TMS)2).
- (b) Por medio de la base mencionada se forma el tautómero (3E)-hexa-3,5-dienoato de 1-(piridin-2-il)etenilo.
- (c) Formación del aducto Diels-Alder (3aR,7aS)-7a-(piridin-2-il)-3a,6,7,7a-tetrahidro-1-benzofuran-2(3H)-ona en presencia de tolueno a 180 °C.
- (d) Se forma el diol cis (3aR,4R,5S,7aS)-4,5-dihidroxi-7a-(piridin-2-il)hexahidro-1-benzofuran-2(3H)-ona, utilizando para este fin tetróxido de osmio y terbutanol acuoso.
- (e) El diol forma un cetal heterocíclico con 2,2-dimetoxipropano, el (3aS,5aS,8aS,8bR)-2,2-dimetil-7a-(piridin-2-il)hexahidrofuro[3,2-e][1,3]benzodioxol-7(4H)-ona. Esto es con el fin de proteger el diol.
- (f) Se hidrogena el anillo de piridina con el catalizador de Adams.
- (g) Se acetila el nitrógeno por medio de la reacción de Schotten-Baumann. La mezcla de estereoisómeros se resuelve para obtener la (3aS,5aS,8aR,8bR)-N-acetil-2,2-dimetil-5a-(piperidin-2-il)hexahidrofuro[3,2-e][1,3]benzodioxol-7(4H)-ona.
- (h) Se elimina el cetal para obtener el (3aR,4R,5S,7aS)-7a-(1-acetilpiperidin-2-il)-4,5-dihidroxihexahidro-1-benzofuran-2(3H)-ona.
- (i) Se forma un tiocarbonato heterocíclico [(3aS,5aS,8aR,8bR)-5a-(1-acetilpiperidin-2-il)-2-tioxohexahidrofuro[3,2-e][1,3]benzodioxol-7(4H)-ona] por la acción de 1,1'-carbonilbiimidazol. Esto es para recuperal el alqueno formado, de manera que durante todo el procedimiento la doble ligadura fue protegida.
- (j) Por medio de una base y cloruro de fenilselenio se forma la cetona α,β-insaturada, (7aS)-7a-(1-acetilpiperidin-2-il)-7,7a-dihidro-1-benzofuran-2(6H)-ona.
- (k) El paso final consiste en una ciclización orientada para formar la securinina.

Referencias
[editar]- ↑ Número CAS
- ↑ Sankawa, U. et al. Phytochemistry (1977) v.16: pp.561- 563
- ↑ Honda et al. "A novel intramolecular Diels-Alder approach to securinega alkaloids: formal synthesis of securinine" Tetrahedron Letters (2000) v.41:pp.5927-5930