Tiazol
| Tiazol | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| 1,3-tiazol | ||
| General | ||
| Otros nombres | tiazol | |
| Fórmula estructural |
 | |
| Fórmula molecular | C3H3NS | |
| Identificadores | ||
| Número CAS | 288-47-1[1] | |
| ChEMBL | CHEMBL15605 | |
| PubChem | 9256 | |
| Propiedades físicas | ||
| Apariencia | líquido incoloro o amarillo pálido con un olor desagradable | |
| Densidad | 1200 kg/m³; 12 g/cm³ | |
| Masa molar | 8513 g/mol | |
| Punto de fusión | −33 °C (240 K) | |
| Punto de ebullición | 117 °C (390 K) | |
| Índice de refracción (nD) | 1,538 | |
| Propiedades químicas | ||
| Acidez | 2,5[2] pKa | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El tiazol, o 1,3-tiazol, es un compuesto heterocíclico que contiene azufre y nitrógeno; el término "tiazol" también se refiere a una gran familia de derivados. El tiazol es un líquido de color amarillo pálido con un olor similar a la piridina y tiene por fórmula molecular C3H3NS.[3] El anillo de tiazol destaca por ser un componente de la vitamina tiamina (B1). Se utiliza en la síntesis orgánica de bactericidas, así como en tintes y promotores de caucho.[4]
Estructura molecular y electrónica
[editar]Los tiazoles son miembros del grupo de heterociclos llamado azoles, que incluyen imidazoles y oxazoles. El tiazol también puede ser considerado como un grupo funcional. Los oxazoles son compuestos relacionados, se pueden considerar como tales sustituyendo el azufre por oxígeno. Los tiazoles también son estructuralmente similares a los imidazoles, con el azufre de tiazol sustituido por nitrógeno, pero no son tan parecidos como en el anterior caso.
El anillo de tiazol es plano, ya que los tiazoles son compuestos aromáticos, y se caracterizan por una deslocalización de electrones pi más grande que los oxazoles correspondientes. Por esto tienen por lo tanto una mayor aromaticidad. Esta aromaticidad se evidencia por el desplazamiento químico de los protones del anillo en la espectroscopia de RMN de protón (entre 7,27 y 8,77 ppm), lo que indica claramente una corriente de anillo diamagnético fuerte. La densidad de electrones pi calculado marca C5 como el sitio principal para la sustitución electrófila, y C2 como el sitio para la sustitución nucleófila.
Síntesis
[editar]Existen diversos métodos de laboratorio para la síntesis orgánica de tiazoles:
- La síntesis de tiazol de Hantzsch (1889): es una reacción entre halocetonas y tioamidas. Por ejemplo, el 2,4-dimetiltiazol se sintetiza a partir acetamida, pentasulfuro de fósforo, y cloroacetona.[5] Otro ejemplo,[6] se muestra abajo:
- En una adaptación de la síntesis de Robinson-Gabriel, 2-acilaminocetonas reaccionan con pentasulfuro de fósforo.
- En la síntesis Cook-Heilbron, una α-aminonitrilo reacciona con sulfuro de carbono.

- Ciertos tiazoles se puede acceder a través de la aplicación de la reacción de Herz.
Reactividad general
[editar]La reactividad del tiazol se puede resumir de la siguiente manera:
- La desprotonación en C2: la carga negativa en esta posición se estabiliza como un iluro; las bases de Hauser y compuestos de organolitio reaccionan en esta posición, sustituyendo al protón.
- El 2-(trimetilsililo)tiazol[7] (con un grupo trimetilsililo en la posición 2) es un sustituto estable y reacciona con una variedad de electrófilos, tales como aldehídos, haluros de acilo, y cetenas.
- La sustitución electrófila aromática en C5 requiere de grupos de activación tales como el grupo metilo en esta bromación:

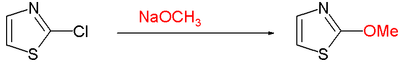
- La sustitución nucleófila aromática en C2 a menudo requiere de buenos grupos electrófugos o grupos salientes, tal como el cloro del ejemplo:
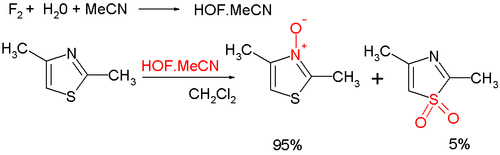
- La oxidación orgánica del nitrógeno da el N-óxido de tiazol. Existen muchos agentes oxidantes, tales como el m-CPBA; uno novedoso es el ácido hipofluoroso (HOF), preparado a partir de flúor y agua en acetonitrilo Parte de la oxidación se lleva a cabo también en el azufre, lo que lleva a generar un sulfóxido como subproducto:[8]
- Los tiazoles pueden reaccionar en reacciones de cicloadición; pero, en general, a altas temperaturas debido a la estabilización aromático favorable de la sustancia reaccionante. Reacciones de Diels-Alder con alquinos seguido por extrusión de azufre, da como producto final una piridina. En un estudio,[9] se encontró que el 2-(dimetilamino)tiazol al reaccionar con acetilenodicarboxilato de dimetilo (DMAD) genera piridina, y el proceso va a través de un intermedio zwitterion en una cicloadición [2+2] formal para dar un ciclobuteno, que luego da una 1,3-tiazepina en una apertura electrocíclica de 4 electrones y luego un 7-tia-2-azanorcaradieno en un cierre electrocíclico de 6 electrones, cerrándose antes de la eliminación del azufre.

Sales de tiazolio
[editar]
La alquilación de tiazoles en el átomo de nitrógeno forma un catión tiazolio. Las sales de tiazolio son catalizadores en la reacción de Stetter y la condensación de benzoína. La desprotonación de las sales de N-alquil tiazolio da los carbenos libres y los complejos de carbeno de metal de transición.[10]
Usos
[editar]El tiazol se usa como material de partida para la producción de fungicidas, productos farmacéuticos, y colorantes. Por ejemplo, forman parte de la vitamina B1, la penicilina, las epotilonas (nueva clase de fármacos antitumorales), luciferina, clometiazol y otros.
Referencias
[editar]- ↑ Número CAS
- ↑ Zoltewicz, J. A. & Deady, L. W. Quaternization of heteroaromatic compounds. Quantitative aspects. Adv. Heterocycl. Chem. 22, 71-121 (1978).
- ↑ The Chemistry of Heterocycles : Structure, Reactions, Syntheses, and Applications Theophil Eicher, Siegfried Hauptmann ISBN 3-527-30720-6
- ↑ «Thiazole».
- ↑ Schwarz, G. (1945). "2,4-Dimethylthiazole". Org. Synth. 25: 35; Coll. Vol. 3: 332.
- ↑ Alajarín, M.; Cabrera, J.; Pastor, A.; Sánchez-Andrada, P.; Bautista, D. (2006). «On the [2+2] Cycloaddition of 2-Aminothiazoles and Dimethyl Acetylenedicarboxylate. Experimental and Computational Evidence of a Thermal Disrotatory Ring Opening of Fused Cyclobutenes». J. Org. Chem. 71 (14): 5328-5339. PMID 16808523. doi:10.1021/jo060664c.
- ↑ Alessandro Dondoni and Pedro Merino (1998). "Diastereoselective Homologation of D-(R)-Glyceraldehyde Acetonide using 2-(Trimethylsilyl)thiazole". Org. Synth.; Coll. Vol. 9: 952.
- ↑ Elizabeta Amir and Shlomo Rozen (2006). «Easy access to the family of thiazole N-oxides using HOF·CH3CN». Chemical Communications 2006 (21): 2262-2264. PMID 16718323. doi:10.1039/b602594c.
- ↑ Mateo Alajarín, José Cabrera, Aurelia Pastor, Pilar Sánchez-Andrada, and Delia Bautista (2006). «On the [2+2] Cycloaddition of 2-Aminothiazoles and Dimethyl Acetylenedicarboxylate. Experimental and Computational Evidence of a Thermal Disrotatory Ring Opening of Fused Cyclobutenes». J. Org. Chem. 71 (14): 5328-5339. PMID 16808523. doi:10.1021/jo060664c.
- ↑ Arduengo, A. J.; Goerlich, J. R.; Marshall, W. J. (1997). «A Stable Thiazol-2-ylidene and Its Dimer». Liebigs Annalen 1997 (2): 365-374. doi:10.1002/jlac.199719970213.

