Triptolide
| Triptolide | ||
|---|---|---|
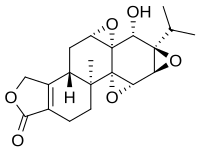 | ||
| General | ||
| Fórmula estructural |
 | |
| Fórmula molecular | C20H24O6 | |
| Identificadores | ||
| Número CAS | 38748-32-2[1] | |
| ChEBI | 9747 | |
| ChEMBL | CHEMBL463763 | |
| ChemSpider | 97099 | |
| PubChem | 107985 | |
| KEGG | C09204 | |
|
CC(C)[C@@]12[C@@H](O1)[C@H]3[C@@]4(O3)[C@]5(CCC6=C([C@@H]5C[C@H]7[C@]4([C@@H]2O)O7)COC6=O)C
| ||
| Propiedades físicas | ||
| Masa molar | 360,41 g/mol | |
| Propiedades químicas | ||
| Solubilidad en agua | 0.017 mg/mL[2] | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Triptolide es un epóxido diterpenoide producido por la vid del dios del trueno, Tripterygium wilfordii. Tiene actividades in vitro e in vivo contra modelos de ratón de enfermedad renal poliquística[3] y cáncer pancreático, pero sus propiedades físicas[4] y toxicidad severa[5] limitan su potencial terapéutico.
En consecuencia, un profármaco sintético soluble en agua, Minnelide, se está estudiando clínicamente en su lugar.[4][6]
Mecanismo de Acción
[editar]Se han informado varias proteínas diana putativas de triptolide, incluyendo policistina-2,[7] ADAM10,[8] DCTPP1,[9] TAB1,[10] y XPB.[11][12] Existen múltiples mutaciones resistentes a triptólidos en XPB (ERCC3) y su proteína asociada GTF2H4.[13] Sin embargo, no se encontraron mutaciones resistentes al triptolide en policistina-2, ADAM10, DCTPP1 y TAB1. Cys342 de XPB se identificó como el residuo que sufre una modificación covalente por el grupo 12,13-epóxido de triptolide, y el mutante XPB-C342T hizo que la línea celular T7115 sea casi completamente resistente al triptolide.[11] El nivel de resistencia conferido por la mutación C342T es aproximadamente 100 veces más alto que el de los mutantes más resistentes a triptólidos identificados previamente.[13] En conjunto, estos resultados validan XPB como un objetivo responsable de la actividad antiproliferativa de triptolide.
Profármacos solubles en agua
[editar]Minnelide es un análogo sintético más soluble en agua de triptolide que se convierte en triptolide in vivo.[4][14] En un modelo de ratón preclínico de cáncer de páncreas, fue "incluso más eficaz que la gemcitabina". Se espera que sus ensayos clínicos de Fase II concluyan en febrero de 2019.[15]
La glutriptolida 2, un conjugado de glucosa de triptólido con mejor solubilidad y menor toxicidad, no inhibió la actividad de XPB in vitro, pero mostró un control del tumor in vivo, lo que probablemente se deba a la liberación gradual sostenida de triptolida activa dentro de las células cancerosas.[16]
Referencias
[editar]- ↑ Número CAS
- ↑ Patil, Satish; Lis, Lev G.; Schumacher, Robert J.; Norris, Beverly J.; Morgan, Monique L.; Cuellar, Rebecca A. D.; Blazar, Bruce R.; Suryanarayanan, Raj; Gurvich, Vadim J.; Georg, Gunda I. (10 de diciembre de 2015). «Phosphonooxymethyl Prodrug of Triptolide: Synthesis, Physicochemical Characterization, and Efficacy in Human Colon Adenocarcinoma and Ovarian Cancer Xenografts». Journal of Medicinal Chemistry 58 (23): 9334-9344. PMC 4678411. PMID 26596892. doi:10.1021/acs.jmedchem.5b01329.
- ↑ Leuenroth, Stephanie (2007). «Triptolide is a traditional Chinese medicine-derived inhibitor of polycystic kidney disease». PNAS 104 (11): 4389-4394. PMC 1838612. PMID 17360534. doi:10.1073/pnas.0700499104. Consultado el 18 de octubre de 2012.
- ↑ a b c Chugh, Rohit (2012). «A Preclinical Evaluation of Minnelide as a Therapeutic Agent Against Pancreatic Cancer». Science Translational Medicine 4 (156): 156ra139. PMC 3656604. PMID 23076356. doi:10.1126/scitranslmed.3004334. Consultado el 18 de octubre de 2012.
- ↑ Liu Q. (2011). «Triptolide and its expanding multiple pharmacological functions». International Immunopharmacology 11 (3): 377-383. PMID 21255694. doi:10.1016/j.intimp.2011.01.012.
- ↑ «Study of Minnelide in Patients With Advanced GI Tumors». Consultado el 6 de octubre de 2016.
- ↑ S. J. Leuenroth, D. Okuhara, J. D. Shotwell, G. S. Markowitz, Z. Yu, S. Somlo, C. M. Crews, Triptolide is a traditional Chinese medicine-derived inhibitor of polycystic kidney disease. Proc Natl Acad Sci U S A 2007, 104, 4389-4394;
- ↑ R. Soundararajan, R. Sayat, G. S. Robertson, P. A. Marignani,Triptolide: An inhibitor of a disintegrin and metalloproteinase 10 (ADAM10) in cancer cells. Cancer Biol Ther 2009, 8, 2054-2062;
- ↑ T. W. Corson, H. Cavga, N. Aberle, C. M. Crews, Triptolide directly inhibits dCTP pyrophosphatase. Chembiochem 2011, 12, 1767-1773;
- ↑ Y. Lu, Y. Zhang, L. Li, X. Feng, S. Ding, W.Zheng, J. Li, P. Shen,TAB1: A Target of Triptolide in Macrophages. Chem. Biol. 2014, 21, 246 – 256.
- ↑ a b Q. L. He, D. V. Titov, J. Li, M. Tan, Z. Ye, Y. Zhao, D. Romo, and J. O. Liu. Covalent Modification of a Cysteine Residue in the XPB Subunit of the General Transcription Factor TFIIH Through Single Epoxide Cleavage of the Transcription Inhibitor Triptolide. Angew. Chem. Int. Ed. 2015, 54, 1859 –1863
- ↑ D. V. Titov, B. Gilman, Q. L.He, S. Bhat,W. K. Low, Y. Dang,M.Smeaton, A. L. Demain, P. S. Miller, J. F. Kugel, J. A. Goodrich,J. O. Liu, XPB, a subunit of TFIIH, is a target of the natural product triptolide. Nat. Chem. Biol. 2011, 7, 182 – 188.
- ↑ a b Y. Smurnyy, M. Cai, H. Wu, E. McWhinnie, J. A. Tallarico, Y.Yang, Y. Feng, DNA sequencing and CRISPR-Cas9 gene editing for target validation in mammalian cells. Nat. Chem. Biol. 2014, 10, 623 – 625
- ↑ Thunder God Vine Drug Zaps Pancreatic Cancer. GenEng. 2012
- ↑ «A Phase II, International Open Label Trial of Minnelide in Patients With Refractory Pancreatic Cancer». ClinicalTrials.gov (en inglés). Consultado el 13 de marzo de 2018.
- ↑ He, Qing-Li; Minn, Il; Wang, Qiaoling; Xu, Peng; Head, Sarah A; Datan, Emmanuel; Yu, Biao; Pomper, Martin G et al. (2016). «Targeted Delivery and Sustained Antitumor Activity of Triptolide through Glucose Conjugation». Angewandte Chemie 128 (39): 12214. doi:10.1002/ange.201606121.
Enlaces externos
[editar]- Esta obra contiene una traducción derivada de «Triptolide» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.