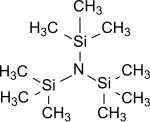
Tris(trimetilsilil)amina
| Tris(trimetilsilil)amina | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| 1,1,1-Trimetil-N,N-bis(trimetilsilil)silanamina | ||
| General | ||
| Fórmula estructural | N(SiMe3)3 | |
| Fórmula molecular | C9H27NSi3 | |
| Identificadores | ||
| Número CAS | 1586-73-8[1] | |
| ChemSpider | 66724 | |
| PubChem | 74110 | |
| UNII | SVA5FGS9US | |
|
N([Si](C)(C)C)([Si](C)(C)C)[Si](C)(C)C
| ||
| Propiedades físicas | ||
| Densidad | 843,6 kg/m³; 0,8436 g/cm³ | |
| Masa molar | 233,57 g/mol | |
| Punto de fusión | 70/71 °C (343/344 K) | |
| Punto de ebullición | 76 °C (349 K) | |
| Peligrosidad | ||
| SGA |
 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La tris(trimetilsilil)amina es la tris(trialquilsilil)amina más simple que tiene la fórmula general (R3Si)3 N, en la que los tres átomos de hidrógeno del amoníaco están reemplazados por grupos trimetilsililo (-Si(CH3)3 ).[2] La tris(trimetilsilil)amina ha estado durante años en el centro del interés científico como intermediario estable en la fijación química del nitrógeno (es decir, la conversión del nitrógeno atmosférico N2 en sustratos orgánicos en condiciones normales).[3][4][5]
Producción
[editar]Los primeros intentos de preparar tris(trimetilsilil)amina a partir de amoníaco y trimetilclorosilano (TMSCl) no tuvieron éxito incluso a temperaturas de 500 °C y en presencia de la base piridina.[6][7]La reacción del amoníaco y el trimetilclorosilano se detiene en la etapa del producto doblemente sililado bis(trimetilsilil)amina (generalmente denominado hexametildisilazano, HMDS).

La tris(trimetilsilil)amina se obtiene por reacción de la sal sódica de hexametildisilazano (a partir de hexametildisilazano y amida sódica[8] o a partir de hexametildisilazano, sodio y estireno[2] con trimetilclorosilano con un rendimiento del 80%.[9]
La sal de litio del hexametildisilazano (obtenida a partir de hexametildisilazano y butillitio[10] o de hexametildisilazano y fenillitio[9] reacciona con trimetilclorosilano sólo con rendimientos del 50-60% para formar tris(trimetilsilil)amina.
La reacción del nitruro de litio con trimetilclorosilano se puede llevar a cabo como una reacción de un solo recipiente (one-pot reaction) en THF con un rendimiento del 72%.[11]
Propiedades
[editar]La tris(trimetilsilil)amina es un sólido incoloro, cristalino o ceroso[8] que es estable al agua y a las bases.[12] Los alcoholes o ácidos rompen el enlace Si-N bajo formación de amoníaco.[8]
Aplicaciones
[editar]Tris(trimetilsilil)amina como componente básico sintético
[editar]A partir del tricloruro de antimonio y la tris(trimetilsilil)amina, se puede formar un Clúster de tipo cubano de nitridoantimona casi cuantitativamente a –60 °C.[13]
Las cetonas se pueden trifluorometilar en presencia de P4-t-Bu y nonametiltrisilazano en condiciones suaves con rendimientos de hasta el 84% con el fluoroformo inerte (HCF3, HFC-23).[14]
El monómero tricloro(trimetilsilil)-fosforanimina Cl3P=NSiMe3 se forma a partir de tris(trimetilsilil)amina y pentacloruro de fósforo en hexano a 0 °C,

que pueden polimerizarse para dar polidiclorofosfacenos lineales con pesos moleculares y polidispersidades definidos.
El trímero cíclico (NPCl2)3 hexaclorociclotrifosfano se forma predominantemente a partir de tris(trimetilsilil)amina y pentacloruro de fósforo en diclorometano hirviendo (aproximadamente 40 °C) entre otros oligómeros que se dan al calentar a más de 250 °C Polidiclorofosfacenos de alto peso molecular, poco definidos.
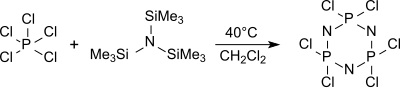
El trifluoruro de nitrógeno NF 3 (que se utiliza, entre otras cosas, para el grabado de plasma de obleas de silicio) se puede obtener a partir de tris(trimetilsilil)amina y flúor a -40 °C en acetonitrilo, suprimiendo la formación de nitrógeno y tetrafluorohidrazina, que se producen como subproductos indeseables durante la síntesis estándar de trifluoruro de nitrógeno a partir de amoníaco o fluoruro de amonio.

Intermedio de la tris(trimetilsilil)amina en la fijación química del nitrógeno
[editar]La fijación técnica del nitrógeno fue posible gracias al proceso Haber-Bosch, en el que el nitrógeno se convierte en amoniaco mediante protonación reductora en presencia de catalizadores de hierro a altas presiones (> 150 bar) y temperaturas (> 400 °C). En la fijación química del nitrógeno (es decir, la transformación del nitrógeno atmosférico en condiciones normales en materiales de partida reactivos para síntesis químicas, normalmente también amoníaco), la tris(trimetilsilil)amina juega un papel importante en la denominada sililación reductora, ya que se hidroliza con agua a amoníaco.
Ya en 1895 se observó que el litio metálico reacciona con el nitrógeno formando nitruro de litio a temperatura ambiente.[15] En 1972, K. Shiina observó que el litio (como donador de electrones ) se forma con cloruro de trimetilsililo bajo oscurecimiento de tris(trimetilsilil)amina en presencia de cloruro de cromo (III) como catalizador a temperatura ambiente con el nitrógeno utilizado para inertizar.[3]
Más recientemente, para la sililación reductora de N2, se ha utilizado sodio en lugar de litio como donador de electrones y molibdeno[16] y compuestos de hierro[4](como hierro pentacarbonílico o ferrocenos[17]) como catalizadores, pudiéndose obtener hasta 34 equivalentes de N(Me3Si)3 por átomo de hierro en el catalizador.
Con un complejo de molibdeno-ferroceno como catalizador se puede alcanzar un número de recambio de hasta 226.[18]
La productividad catalítica de los catalizadores para la fijación química de nitrógeno desarrollados hasta ahora es, a pesar de una intensa investigación,[19] todavía en magnitud menor que, por ejemplo, los modernos catalizadores de polimerización del tipo metaloceno o las enzimas.
Referencias
[editar]- ↑ Número CAS
- ↑ a b J. Goubeau, J. Jiminéz-Barberá (1960), «Tris-(trimethylsilyl)-amin», ZAAC (en alemán) 303 (5–6): 217-226, doi:10.1002/zaac.19603030502.
- ↑ a b K. Shiina (1972), «Reductive silylation of molecular nitrogen via fixation to tris(trimethylsilyl)amine», J. Am. Chem. Soc. 94 (26): 9266-9267, doi:10.1021/ja00781a068.
- ↑ a b K.C. MacLeod, P.L. Holland (2013), «Recent developments in the homogeneous reduction of dinitrogen by molybdenum and iron», Nature Chemistry 5 (7): 559-565, Bibcode:2013NatCh...5..559M, PMC 3868624, PMID 23787744, doi:10.1038/nchem.1620.
- ↑ W.I. Dzik (2016), «Silylation of dinitrogen catalyzed by hydridodinitrogen(triphenylphosphine) cobalt (I)», Inorganics 4 (3): 21, doi:10.3390/inorganics4030021.
- ↑ R.O. Sauer (1944), «Derivatives of the methylchlorosilanes. I. Trimethylsilanol and its simple ethers», J. Am. Chem. Soc. 66 (10): 1707-1710, doi:10.1021/ja01238a030.
- ↑ R.O. Sauer, R.H. Hasek (1946), «Derivatives of the methylchlorosilanes. IV. Amines», J. Am. Chem. Soc. 68 (2): 241-244, doi:10.1021/ja01206a028.
- ↑ a b c C.R. Krüger, H. Niederprüm, M. Schmidt, O. Scherer (1966), H.F. Holtzlow, ed., Sodium Bis(trimethylsilyl)amide and Tris(trimethylsilyl)amine, in Inorganic Syntheses 8, Hoboken, NJ, USA: John Wiley & Sons, Inc., pp. 15-19, ISBN 9780470131671, doi:10.1002/9780470132395.ch5.
- ↑ a b U. Wannagat, H. Niederprüm (1961), «Beiträge zur Chemie der Silicium-Stickstoff-Verbindungen, XIII. Silylsubstituierte Alkaliamide», Chem. Ber. (en alemán) 94 (6): 1540-1547, doi:10.1002/cber.19610940618.
- ↑ E.H. Amonoo-Neizer, R.A. Shaw, D.O. Skovlin, B.C. Smith, J.W. Rosenthal, W.L. Jolly (1966), H.F. Holtzlow, ed., Lithium Bis(trimethylsilyl)amide and Tris(trimethylsilyl)amine, in Inorganic Syntheses 8, Hoboken, NJ, USA: John Wiley & Sons, Inc., pp. 19-22, ISBN 9780470131671, doi:10.1002/9780470132395.ch5.
- ↑ W.L. Lehn (1964), «Preparation of tris(trimethylsilyl)- and tris(trimethylstannyl)amines», J. Am. Chem. Soc. 86 (2): 305, doi:10.1021/ja01056a057.
- ↑ U. Wannagat, H. Niederprüm (1961), «dreifach silylierte Amine», ZAAC (en alemán) 308 (1–6): 337-351, doi:10.1002/zaac.19613080135.
- ↑ M. Rhiel, F. Weller, J. Pebler, K. Dehnicke (1994), «[SbN(SbCl)3(NSbCl2)(NSiMe3)3·SbCl3], ein ungewöhnlicher Nitridoantimonkomplex mit Heterocubanstruktur», Angew. Chem. (en alemán) 106 (5): 599-600, Bibcode:1994AngCh.106..599R, doi:10.1002/ange.19941060519.
- ↑ S. Okusu, K. Hirano, E. Tokunaga, N. Shibata (2015), «Organocatalyzed trifluormethylation of ketones and sulfonyl fluorides by fluoroform under a superbase system», ChemistryOpen 4 (5): 581-585, PMC 4608523, PMID 26491635, doi:10.1002/open.201500160.
- ↑ H. Deslandres (1895), «Absorption de l'azote par le lithium à froid», Comptes rendus 121: 886-887.
- ↑ Q. Liao, N. Saffon-Merceron, N. Mézailles (2015), «N2 reduction into silylamine at tridentate phosphine/Mo center: catalysis and mechanistic study», ACS Catal. 5 (11): 6902-6906, doi:10.1021/acscatal.5b01626.
- ↑ M. Yuki, H. Tanaka, K. Sasaki, Y. Miyake, K. Yoshizawa, Y. Nishibayashi (2012), «Iron-catalyzed transformation of molecular dinitrogen into silylamine under ambient conditions», Nature Communications 3: 1254, Bibcode:2012NatCo...3.1254Y, PMID 23212383, doi:10.1038/ncomms2264.
- ↑ H. Tanaka (2011), «Molybdenum-Catalyzed Transformation of Molecular Dinitrogen into Silylamine: Experimental and DFT Study on the Remarkable Role of Ferrocenyldiphosphine Ligands», J. Am. Chem. Soc. 133 (10): 3498-3506, PMID 21341772, doi:10.1021/ja109181n.
- ↑ Y. Nishibayashi (2015), «Recent progress in transition-metal-catalyzed reduction of molecular dinitrogen under ambient reaction conditions», Inorg. Chem. 54 (19): 9234-9247, PMID 26131967, doi:10.1021/acs.inorgchem.5b00881.
![{\displaystyle {\begin{matrix}{}\\{\ce {[(CH3)3Si]2NH ->[+{\ce {NaNH2}}][-{\ce {NH3}}] NaN[Si(CH3)3]2 ->[+{\ce {ClSi(CH3)3}}][-{\ce {NaCl}}] N[Si(CH3)3]3}}\\{}\end{matrix}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/78549476135b927dc95d6c81bc50de9b89e0b7ae)

![{\displaystyle {\ce {{N2}+{6e^{-}}->[{\ce {Catalyst:}}\ {\ce {Mo}},\ {\ce {Fe}},\ {\ce {Co}}]}}{\begin{cases}{\ce {->[{\ce {H+}}]}}&{\ce {2NH3}}\\{}\\{\ce {->[{\ce {R3Si-X}}][-\,{\ce {X-}}]}}&{\ce {2N(SiR3)3}}\end{cases}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7aa5ae0b13d71a31c97f22297303dee5ed50221a)
![{\displaystyle {\ce {N2 + 6Me3SiCl + 6}}\,{\color {NavyBlue}{\ce {Li}}}\ {\ce {->[{\ce {CrCl3}}] 2N(SiMe3)3 + 6}}\,{\color {NavyBlue}{\ce {Li}}}{\ce {Cl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b7e5556a07b9c108214c4261b7694524d5af5665)
![{\displaystyle {\ce {N2 + 6Me3SiCl + 6}}\,{\color {Red}{\ce {Na}}}\ {\ce {->[{\ce {Fe-catalyst}}] 2N(SiMe3)3 + 6}}\,{\color {Red}{\ce {Na}}}{\ce {Cl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ecf55c39b3edb4a67900c2fb80e508b6a1b31d91)
![{\displaystyle {\color {Red}{\ce {N2}}}+{\color {NavyBlue}{\ce {Me3Si}}}{\ce {{Cl}+Na->[{\ce {Mo/Fe-catalyst}}.][{\ce {RT}} \atop (1\ {\ce {atm}})]}}\ {\color {Red}{\ce {N}}}{\color {NavyBlue}{\ce {(Me3Si)3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6e5a412bc2fab4fa67528a1779b7c318068be6f7)