Ácido trifluorometansulfónico
| Ácido trifluorometansulfónico | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| Ácido trifluorometansulfónico | ||
| General | ||
| Otros nombres | Ácido tríflico, HOTf, TfOH | |
| Fórmula semidesarrollada | CF3SO3H | |
| Fórmula estructural |
 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 1493-13-6[1] | |
| ChEBI | 48511 | |
| ChEMBL | CHEMBL1236265 | |
| ChemSpider | 56192 | |
| PubChem | 71773376 62406, 71773376 | |
| UNII | JE2SY203E8 | |
| Propiedades físicas | ||
| Apariencia | incolora | |
| Densidad | 1,696 kg/m³; 0,001696 g/cm³ | |
| Masa molar | 150,08 g/mol | |
| Punto de fusión | 233 K (−40 °C) | |
| Punto de ebullición | 435 K (162 °C) | |
| Propiedades químicas | ||
| Acidez | -14,9 pKa | |
| Solubilidad en agua | Miscible | |
| Riesgos | ||
| Riesgos principales | Corrosivo | |
| Ojos | Irritante | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El ácido trifluorometansulfónico, también conocido como ácido tríflico, HOTf, o TfOH, es un ácido sulfónico con fórmula CF3SO3H. Suele ser considerado uno de los ácidos más fuertes, y es uno de los denominados "superácidos". El ácido tríflico es usado ampliamente, especialmente como catalizador y un precursor en química orgánica.[2][3]
Propiedades
[editar]El ácido tríflico es un líquido incoloro, higroscópico a temperatura ambiente. Es soluble en solventes polares como el DMF, DMSO, acetonitrilo, y dimetilsulfona. La adición de ácido tríflico a solventes polares puede ser peligrosamente exotérmica.
Con una Ka = 8.0 ×1014 (pKa ~ -15) el HOTf califica como superácido. El ácido tríflico debe muchas de sus propiedades útiles a su alta estabilidad térmica y química. Tanto el ácido y su base conjugada CF3SO3-, conocida como triflato, resisten reacciones redox, mientras que muchos ácidos fuertes son oxidantes, como el HClO4 y HNO3. El anión triflato es inmune al ataque por, incluso, los nucleófilos más potentes. Debido a su resistencia a la oxidación y reducción, el ácido tríflico no sulfona sustratos, lo que puede ser un problema con el ácido sulfúrico, ácido fluorosulfónico, y el ácido clorosulfónico.
El ácido tríflico hace humos en aire húmedo, y forma un monohidrato sólido estable, CF3SO3H·H2O, cuyo punto de fusión es 34 °C.
Historia y síntesis
[editar]El ácido trifluorometanslfónico fue sintetizado por primera vez en 1954 por R. N. Haszeldine y J. M. Kidd por la reacción siguiente:[4]
Otras formas de sintetizar el ácido trifluorometansulfónico incluyen la fluoración electroquímica (ECF).
La síntesis industrial involucra la hidrólisis del CF3SO2F, seguida por acidificación. El ácido tríflico es purificado por destilación del anhídrido tríflico.[3]
Usos
[editar]El ácido tríflico es útil en protonaciones, debido a que la base conjugada del ácido tríflico no reacciona con otros reactivos.
Formación de sales
[editar]El ácido trifluorometansulfónico reacciona exotérmicamente con carbonatos e hidróxidos de metales. Es ilustrativa la síntesis del Cu(OTf)2.
- CuCO3 + 2 CF3SO3H → Cu(O3SCF3)2 + H2O + CO2
Mucho más interesante en términos de síntesis química es la conversión de complejos de cloro a los triflatos correspondientes. Como ilustración está la síntesis del [Co(NH3)5OTf]2+:
- 3 CF3SO3H + [Co(NH3)5Cl]Cl2 → [Co(NH3)5O3SCF3](O3SCF3)2 + 3 HCl
Esta conversión es llevada a cabo en HOTf a 100 °C, seguido por precipitación de la sal por adición de éter.
Reacciones orgánicas
[editar]El ácido tríflico reacciona con halogenuros de acilo para producir anhídridos mixtos, que son agentes acilantes fuertes, por ejemplo, en reacciones de Friedel-Crafts.
- CH3C(O)Cl + CF3SO3H → CH3C(O)OSO2CF3 + HCl
- CH3C(O)OSO2CF3 + C6H6 → CH3C(O)C6H5 + CF3SO3H
El ácido tríflico cataliza la reacción de compuestos aromáticos con cloruros de sulfonilo, probablemente mediante la intermediación de un anhídrido mixto. Otras reacciones del tipo de Friedel-Crafts que usan ácido tríflico incluyen el cracking de alcanos y la alquilación de alquenos, que son muy importantes en la industria del petróleo. Estos catalizadores derivados del ácido tríflico son muy efectivos en ismerizar cadenas lineales o poco ramificadas, lo que aumenta el índice de octano de un combustible particular basado en petróleo.
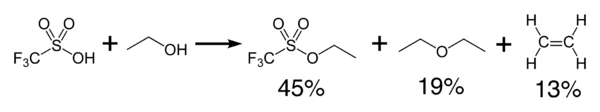
El ácido tríflico reacciona exotérmicamente con alcoholes para producir éteres y olefinas. Puede ser usado como catalizador para la condensación de alcoholes y ácidos carboxílicos.
Referencias
[editar]- ↑ Número CAS
- ↑ Howells, R. D., McCown, J. D. (1977). «Trifluoromethanesulfonic Acid and Derivatives». Chemical Reviews 77: 69-92. doi:10.1021/cr60305a005.
- ↑ a b «Trifluoromethanesulfonic Acid». Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, Ltd. 2006. doi:10.1002/047084289X.rt246.pub2.
- ↑ R. N. Haszeldine and J. M. Kidd (1954). «Perfluoroalkyl derivatives of sulphur. Part I. Trifluoromethanesulphonic acid». J. Chem. Soc.: 4228-4232. doi:10.1039/JR9540004228.
Bibliografía adicional
[editar]- Dixon, N. E.; Lawrance, G. A.; Lay, P. A.; Sargeson, A. M.; Taube, H. (1990). «Trifluoromethanesulfonates and trifluoromethanesulfonato-O complexes». Inorganic Syntheses 28: 70-76. doi:10.1002/9780470132593.ch16.

