Éster de nitrato
Un éster de nitrato es un grupo funcional, generalmente orgánico. El término es relativamente ambiguo y hay nombres en competencia que, aunque no cubren exactamente la misma realidad en el lenguaje cotidiano, se utilizan como cuasi-sinónimos.
- En su definición amplia, un éster es el producto de la condensación entre cualquier ácido (mineral u orgánico) y un alcohol. Por tanto, un éster de nitrato es el producto de la condensación entre ácido nítrico y un compuesto orgánico que comprende una función alcohol (-OH). Su fórmula general es RONO2, donde R es un grupo orgánico. También hablamos fácilmente de "organonitrato".
- Otro término común es el nombre “nitrato de alquilo”, que en sentido estricto designa el producto de condensación entre el ácido nítrico que es un alcanol (R-OH). En el último caso, la fórmula general sigue siendo RONO2, pero esta vez R es un grupo alquilo puro, no un grupo orgánico general (es decir, un derivado de alquilo que puede tener otras funciones). Por lo tanto, esta familia teóricamente solo contendría nitrato de metilo, nitrato de etilo, nitrato de pentilo, etc. Sin embargo, en el lenguaje cotidiano, los alquilos y sus derivados se agrupan regularmente bajo el nombre simple de "alquilo", por lo que "nitrato de alquilo" se convierte en sinónimo de la definición anterior.
Por tanto, este artículo trata sobre compuestos orgánicos de fórmula general RONO2 donde R es cualquier grupo orgánico.
-
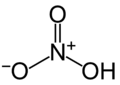
ácido nítrico, precursor de ésteres de nitrato.
-
Nitrato de metilo, el más simple de los ésteres de nitrato.
-
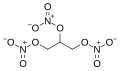
nitroglicerina, uno de los ésteres de nitrato más conocido.
-
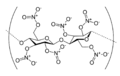
Nitrocelulosa, polímero orgánico que contiene muchos grupos éster de nitrato.
-
tetranitrato de pentaeritritol, es un explosivo comercialmente importante que contiene cuatro grupos de ésteres de nitrato.
Los ésteres de nitrato no deben confundirse con un grupo estrechamente relacionado, los compuestos nitro (RNO2) que tienen un oxígeno menos y donde el grupo orgánico está directamente ligado al nitrógeno central. Esta confusión se ve amplificada por el hecho de que muchos nitratos de alquilo tienen un nombre común que comienza con el prefijo nitro-; este es, por ejemplo, el caso de la nitroglicerina y la nitrocelulosa, que son de hecho nitratos de alquilo, respectivamente trinitrato de glicerol y nitrato de celulosa, y no compuestos nitro.
Síntesis y reacciones
[editar]Los ésteres de nitrato son usualmente preparados por condensación de ácido nítrico y alcohol:[1] Por ejemplo, el éster de nitrato más sencillo, el nitrato de metilo, es formado por la reacción de metanol con ácido nítrico en la presencia de ácido sulfúrico:[2]
- CH3OH + HNO3 → CH3ONO2 + H2O
Esta condensación es a veces llamada "nitroxilación".
Propiedades explosivas
[editar]La descomposición térmica de ésteres de nitrato produce principalmente los gases nitrógeno molecular (N2) y dióxido de carbono. La considerable energía química de la detonación se debe a la alta fortaleza del enlace en el nitrógeno molecular. Esta estequiometría se ilustra en la ecuación para la detonación de la nitroglicerina:
Ejemplo de la naturaleza altamente sensible de algunos nitratos orgánicos es el silicio pentaeritritol tetranitrato Si(CH2ONO2)4.[3][4] Un solo cristal de este compuesto detona incluso al contacto con una espátula de teflón y hace de hecho imposible su completa caracterización. Otro contribuyente a su descomposición exotérmica (inferida desde la mucho más segura experimentación in silico) es la capacidad del silicio en su fase cristalina para coordinarse con dos grupos nitrito de oxígeno además de la coordinación regular a los cuatro átomos de carbono. Esta coordinación adicional facilitaría la formación de dióxido de silicio (uno de los productos de descomposición).
Uso médico
[editar]Los ésteres de nitrato dinitrato de isosorbida (Isordil) y mononitrato de isosorbida (Imdur, Ismo, Monoket, Mononitron) son convertidos en el cuerpo a óxido nítrico, un potente vasodilator natural. En medicina, estos ésteres son utilizados como medicina para la angina de pecho (enfermedad isquémica del corazón).
Compuestos relacionados
[editar]El nitrato de acetilo es un anhídrido de nitrato, siendo derivado de la condensación de ácidos nítricos y acéticos.
Véase también
[editar]Referencias
[editar]- ↑ Snyder, H. R. (1942). "Imidazole". Org. Synth.; Coll. Vol. 3: 471.
- ↑ Alvin P. Black. "Methyl nitrate". Org. Synth.; Coll. Vol. 2: 412.
- ↑ The Sila-Explosives Si(CH2N3)4 and Si(CH2ONO2)4: Silicon Analogues of the Common Explosives Pentaerythrityl Tetraazide, C(CH2N3)4, and Pentaerythritol Tetranitrate, C(CH2ONO2)4Thomas M. Klapötke, Burkhard Krumm, Rainer Ilg, Dennis Troegel, and Reinhold Tacke J. Am. Chem. Soc.; 2007 doi 10.1021/ja071299p
- ↑ Sila-Explosives Offer A Better Bang Stephen K. Ritter Chemical & Engineering News May 7 2007Link