N-butüülliitium
See artikkel ootab keeletoimetamist. |
| n-butüülliitium | |
|---|---|
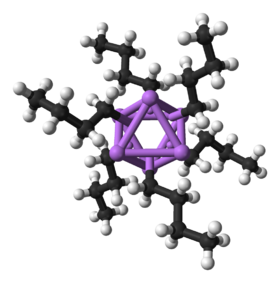 n-butüülliitium (heksameer) | |
| Üldised omadused | |
| Keemiline valem | C4H9Li |
| Välimus | värvitu vedelik |
| Füüsikalised omadused | |
| Molaarmass | 64,06 g/mol g/mol |
| Sulamistemperatuur | 197,15 K (−76 °C) |
| Tihedus | 0,68 g/cm3 kg/m³ |
| Lahustuvus | reageerib ägedalt |
| Kasutatakse SI-süsteemi ühikuid. Kui pole teisiti öeldud, eeldatakse normaaltingimusi. | |
n-butüülliitium (lühend n-BuLi) on liitiumorgaaniline ühend, kus esineb polaarne kovalentne side liitiumi aatomi ja butüülrühma süsiniku vahel. Ühendit kasutatakse laialdaselt elastomeeride, nagu polübutadieen, polümerisatsiooni initsiaatorina. Nii tööstuses kui ka laboris on aine kasutusel orgaanilistes sünteesides tugeva alusena. Kaubanduslikult on butüülliitiumi saada lahustena (15%, 25%, 2M, 2,5M, 10M jne) alkaanides, nagu heptaan või heksaan. Võimalik on valmistada ka dietüüleetri ja tetrahüdrofuraani (THF) lahuseid, kuid need on hoiustamiseks liiga ebastabiilsed. Iga aasta toodetakse umbes 1800 tonni butüülliitiumi ja teisi liitiumorgaanilisi ühendeid.

Alkaanide lahustes on n-butüülliitium helekollane ning korralikult hoiustatuna võiksid nad olla stabiilsed pikka aega. Praktikas esineb aga aine vananemine, mille tulemusena sadestub valge liitiumhüdriid ning lahus muutub oranžikaks.[1]
Struktuur
[muuda | muuda lähteteksti]Nii tahkena kui lahuses esineb n-BuLi oligomeerina. Kalduvus agregeeruda on peaaegu kõigil liitiumorgaanilistel ühenditel. Oligomeere hoiab koos delokaliseritud kovalentne side liitiumi ja süsiniku vahel.[2] n-butüülliitiumi puhul esineb kõige enam tetrameerne (dietüületris) ja heksameerne (tsükloheksaanis) vorm. Tetrameeri korral butüülrühmad paiknevad tetraeedri iga tahu keskmes, olles korraga ühenduses kolme Li-aatomiga. Polümerisatsiooniaste sõltub suuremalt jaolt orgaanilise rühma struktuurist, lahuste puhul ka lahustist, kusjuures mida polaarsem lahusti, seda vähemal määral on ühend assotsieerunud. Tänu suurele elektronegatiivsuste erinevusele liitiumi (0,98) ja süsiniku (2,55) vahel, on C-Li side ülipolaarne. Seetõttu võib n-butüülliitiumi kujutada praktikas reageerimas kui butüülanioonina (n-Bu-) ja liitiumkatioonina (Li+).
Süntees
[muuda | muuda lähteteksti]Standardne reaktsioon n-BuLi valmistamiseks on 1-bromobutaani või 1-klorobutaani reageerimine Li metalliga:[1]
Solvendina kasutatakse selles reaktsioonis benseeni, tsükloheksaani või dietüüleetrit. Kui lähteaineks on BuBr, on saaduseks homogeenne lahus, mis sisaldab nii liitiumbromiidi, butüülliitiumi kui ka väikeses koguses oktaani (tekib kahe butüülrühma liitumisel). Liitiumkloriidiga moodustab butüülliitium nõrgema kompleksühendi, mistõttu BuCl reageerimisel liitiumiga tekib LiCl sade ning liitiumorgaaniline ühend on seega ka kergemini reaktsioonisegust eraldatav.
Reaktsioonid
[muuda | muuda lähteteksti]Butüülliitium on tugev alus (pKa≈50), kuid sõltuvalt teistest lähteainetest ka tugev nukleofiil ja redutseerija. Peale selle suudab n-BuLi siduda ennast aprotoonsete Lewisi alustega, nagu dietüüleeter ja tertsiaarsed Amiinid, lõhkudes seeläbi oma oligomeerset struktuuri ning parandades oma reaktsioonivõimet.
Metalleerimine
[muuda | muuda lähteteksti]Üks parimaid n-BuLi keemilisi omadusi on võime deprotoneerida suurt osa erinevaid Brønstedi happeid. See tähendab, et ta suudab metalleerida erinevaid C-H sidemeid, eriti kui konjugeeritud alus on stabiliseeritud elektronide delokalisatsiooniga või teiste heteroaatomitega (mitte süsinikuaatom). Taolised ained on näiteks atsetüleenid (H-CC-R), metüülsulfiidid (H-CH2-SR), tioatsetaalid (H-CH(SR)2), metüülfosfiinid (h-Ch2PR2) ja furaanid.[3] Lisaks neile deprotoneerib n-butüülliitium kõiki happelisemaid ühendeid, nagu alkoholid, amiinid ja enoolid, moodustades vastvalt alkoksiide, amiide ja enolaate. Reaktsioonivõimet parandab ka tekkiva butaani kõrge stabiilsus ning lenduvus. Suurte koguste juures tuleb siiski arvestada gaasi süttivusega.
- LiC4H9 + R-H -> C4H10 + R-Li
Reaktsioonikiirust saab suurendada, kui lisada reaktsioonisegule Li+ katiooniga kompleksi moodustavat ainet, nagu tetrametüületüleendiamiin (TMEDA).
Halogeen-liitium vahetusreaktsioon
[muuda | muuda lähteteksti]Osade orgaaniliste bromiidide ja jodiididega osaleb n-butüülliitium vahetusreaktsioonis, andes saaduseks vastava liitiumorgaanilise derivaadi. Kloriidide ja fluoriidide korral reaktsioon tavaliselt ei toimu:
- C4H9Li + R-X → C4H9X + R-Li (X = Br, I)
Vastavat lähenemist kasutatakse erinevate liitiumorgaaniliste ühendite, eriti arüülliitiumite ja osade vinüülliitiumite saamiseks. Selle meetodi saagis on aga piiratud, kuna saadused võivad edasi reageerida andes kõrvalsaaduseks vastava liitiumhalogeniidi ning orgaanilise aine:[1]
- C4H9X + R-Li → LiX + R-C4H9 (X = Br, I)
Transmetalleerimine
[muuda | muuda lähteteksti]Nagu nimigi ütleb, vahetavad orgaanilised rühmad selle reaktsiooni korral omavahel metalliaatomid. Tihtipeale vahetab liitium oma koha just tinaga:
- C4H9Li + Me3SnAr → Me3SnC4H9 + ArLi
- (Me – metüülrühm, Ar – arüülrühm, Sn – tina)
Tekkinud tinaühend on vähem reaktiivne liitiumi ühendite suhtes, kui vastavad halogeenühendid, mistõttu on transmetalleerimine eelistatum kui halogeen-liitium vahetusreatsioon. Peale tina võib reaktsioonides kasutada ka elavhõbedat, seleeni või telluuri.
Karbonüüli liitmine
[muuda | muuda lähteteksti]Erinevaid liitiumorgaanilisi ühendeid kasutatakse spetsiifiliste aldehüüdide ja ketoonide sünteesimisel:
- R1Li + R²CONMe2 → LiNMe2 + R²C(O)R1
Ohutus
[muuda | muuda lähteteksti]Liitiumorgaanilised ühendid on ülimalt pürofoorsed: nad võivad hapniku, õhu või niiskuse käes iseenesest süttida. n-BuLi reageerib tormiliselt veega:
- C4H9Li + H2O → C4H10 + LiOH
Samuti annab ta reaktsiooni süsihappegaasiga:
- C4H9Li + CO2 → C4H9CO2Li
Et säilitada liitiumorgaaniliste ühendite omadusi, peab neid säilitama inertgaasi (Ar, N2) atmosfääris ning veevabas keskkonnas. Samu reegleid tuleb jälgida nendega ümberkäimisel.
Viited
[muuda | muuda lähteteksti]- ↑ 1,0 1,1 1,2 Brandsma, L.; Verkraijsse, H. D. (1987). Preparative Polar Organometallic Chemistry I. Berlin: Springer-Verlag. ISBN 3-540-16916-4..
- ↑ Elschenbroich, C. "Organometallics" (2006) Wiley-VCH: Weinheim. ISBN 978-3-29390-6.
- ↑ Sanders, R.; Mueller-Westerhoff, U. T. (1996). "The Lithiation of Ferrocene and Ruthenocene — A Retraction and an Improvement". Journal of Organometallic Chemistry. 512 (1–2): 219–224. DOI:10.1016/0022-328X(95)05914-B.
Välislingid
[muuda | muuda lähteteksti]- FMC Lithium manufacturer's product sheets
- Environmental Chemistry directory
- Weissenbacher, Anderson, Ishikawa, Organometallics, July 1998, p681.7002, Chemicals Economics Handbook SRI International
- HPV test plan, submitted by FMC Lithium to EPA
- Ovaska, T. V. e-EROS Encyclopedia of Reagents for Organic Synthesis "n-butyllithium." Wiley and sons. 2006. DOI:10.1002/047084289X.rb395
- Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements, 2nd ed. 1997: Butterworth-Heinemann, Boston.