Proteiinkinaasid

Proteiinkinaasid[1] ehk proteiini kinaasid ehk valgu kinaasid on kinaassed ensüümid (EC-number=2.7.-.-), ka eukarüootsete organismide valkude superpere, mis modifitseerivad valke fosfaatrühma lisamise teel (fosforüleerimine). Fosforüleerimine mõjutab sihtmärkvalgu (substraadi) funktsiooni tavaliselt kas substraadi aktiivsuse, rakus paiknemise või sidumisomaduste muutmise kaudu.
Inimgenoomis klassifitseeriti aastal 2002 ligikaudu 500 proteiinkinaase kodeerivat geeni, mis moodustab ligikaudu 2% kogu genoomist.[2] Aastaks 2009 oli klassifitseeritud juba üle 900 proteiinkinaase kodeeriva geeni.[3]
Proteiinkinaase leidub ka bakterites ja taimedes. Kuni 30% kõigist inimorganismi valkudest modifitseeritavad proteiinkinaasid ning on teada, et proteiinkinaasid reguleerivad suurt osa raku signaaliülekande radadest.
Keemiline aktiivsus
[muuda | muuda lähteteksti]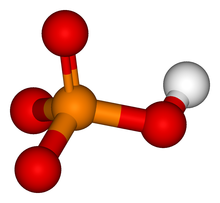
Proteiinkinaaside katalüütiline toime seisneb fosfaatrühma ülekandmises mõne nukleosiidi trifosfaadilt (tavaliselt ATP-lt) vaba hüdroksüülrühmaga aminohappele. Enamik kinaase fosforüleerib seriini/treoniini, veidi vähem on neid, mille substraadiks on türosiin või kõik kolm mainitud aminohapet (topelt-spetsiifilised kinaasid).[4] Esineb ka proteiinkinaase, mis fosforüleerivad teisi aminohappeid, näiteks histidiini.[5]
Regulatsioon
[muuda | muuda lähteteksti]Proteiinkinaasid korraldavad suurt osa raku elust ja seetõttu on nende aktiivsus tugevalt reguleeritud. Kinaase saab aktiveerida või deaktiveerida näiteks fosforüleerimisega (vahel isegi kinaasi enda poolt – cis-fosforüleerimine/autofosforüleerimine[6]), aktivaator- või inhibiitorvalkude sidumisega, väikesemolekuliste inhibiitorite abil või muutes kinaasi paiknemist valgus substraadi suhtes.
Struktuur
[muuda | muuda lähteteksti]Eukarüootsed proteiinkinaasid kuuluvad suurde valkude perekonda, mis koosneb suuresti säilinud katalüütilise alaühikuga ensüümidest.[7][8][9][10] Röntgenkristallograafiliste meetoditega on suudetud tuvastada erinevate kinaaside struktuurid.[11]
Proteiinkinaaside katalüütilises alaühikus on mitmeid konserveeritud piirkondi. N-terminaalses otsas asub glütsiinirikas järjestus, mille läheduses on lüsiin. On näidatud, et sellised järjestused osalevad ATP sidumisel. Katalüütilise alaühiku keskel asub aspartaat, mis on oluline ensüümi katalüütilise aktiivsuse tagamiseks.[12]
Proteiinkinaaside rühmad
[muuda | muuda lähteteksti]Inimese proteiinkinaaside perekond on jagatud järgmistesse rühmadesse:
- AGC-kinaasid – nende hulgas PKA, PKC, PKG
- CaM-kinaasid – kaltsiumi/kalmoduliini poolt reguleeritud kinaasid
- CK1 – kaseiinkinaas 1 rühm
- CMGC – CDK-, MAPK-, GSK3- ja CLK-kinaasid
- STE – pärmi Sterile 7, Sterile 11 ja Sterile 20 kinaaside homoloogid
- Türosiinkinaasid
- TKL – türosiinkinaaside sarnaste kinaaside rühm
Seriini/treoniini-spetsiifilised proteiinkinaasid
[muuda | muuda lähteteksti]
Seriini/treoniini-spetsiifilised proteiinkinaasid (EC 2.7.11.1) fosforüleerivad seriini või treoniini hüdroksüülrühma. Nende proteiinkinaaside aktiivsust reguleerivad mitmesugused keemilised signaalid, sealhulgas cAMP, cGMP, diatsüülglütserool ja Ca2+/kalmoduliin. Üks väga tähtis proteiinkinaaside rühm on MAP-kinaasid (mitogeen-aktiveeritud proteiinkinaasid). Olulisemaid alarühmi moodustavad mitogeensete signaalide poolt aktiveeritud ERK alamperekonda kuuluvad kinaasid ja stressi poolt aktiveeritud proteiinkinaasid JNK ja p38.
Kuigi MAP-kinaasid on seriini/treoniini-spetsiifilised, aktiveeritakse neid nii seriini/treoniini kui ka türosiini kombineeritud fosforüleerimisega. MAP-kinaaside aktiivsust piiravad mitmed fosfataasid, mis eemaldavad aktiivse konformatsiooni tekkimiseks vajalikke fosfaatrühmi. Kaks põhilist tegurit, mis mõjutavad MAP-kinaaside aktiivsust on:
- signaalid, mis aktiveerivad transmembraanseid retseptoreid (kas siis looduslikud ligandid või ristsidemeid tekitavad reagendid) ja nendega seotud valke
- signaalid, mis lülitavad välja MAP-kinaaside aktiivsust piiravaid fosfataase. Selliste signaalide hulka kuulub näiteks oksüdatiivne stress.[13]
Türosiini-spetsiifilised proteiinkinaasid
[muuda | muuda lähteteksti] Pikemalt artiklis Türosiinkinaasid
Pikemalt artiklis Türosiinkinaasid
Türosiini-spetsiifilised proteiinkinaasid fosforüleerivad türosiinijääke ja nagu ka seriini/treoniini-spetsiifilised kinaasid, osalevad türosiinkinaasid signaaliülekandes. Põhiliselt käituvad türosiinkinaasid kasvufaktorite retseptoritena ja kasvufaktorite signaaliradade osadena.[14]
Retseptor-türosiinkinaasid
[muuda | muuda lähteteksti]Retseptor-türosiinkinaasid koosnevad transmembraansest retseptorist, millel on tsütoplasmasse ulatuv türosiinkinaasi domeen. Retseptor-türosiinkinaasid mängivad olulist rolli rakkude jagunemise, diferentsieerumise ja morfogeneesi reguleerimisel. On teada rohkem kui 50 imetajate retseptor-türosiinkinaasi.
Struktuur
[muuda | muuda lähteteksti]Ligandi siduvaks molekuliosaks on rakuväline domeen. See võib olla iseseisev üksus, mis on ülejäänud retseptoriga ühendatud disulfiidsidemega. Samasugune mehhanism esineb ka kahe retseptori sidumisel homo- või heterodimeeriks. Membraani läbiv osa koosneb ühest α-heeliksist, rakusisene domeen täidab mitmeid regulatoorseid funktsioone ning on ka vastutav kinaasi aktiivsuse eest.
Regulatsioon
[muuda | muuda lähteteksti]Ligandi sidumisega kaasneb:
- Kahe monomeerse retseptorkinaasi dimeriseerumine või dimeeri stabiliseerumine. Mitmed retseptor-türosiinkinaaside ligandid on mitmevalentsed. Mõned retseptor-türosiinkinaasid saavad moodustada heterodimeere teiste sarnaste kinaasidega samast alaperekonnast. Selline mehhanism võimaldab rakuvälise signaali saamisel edastada keerulisi vastuseid.
- Kinaasi trans-autofosforüleerimine (fosforüleerimine dimeeris või multimeeris oleva teise kinaasi poolt).
Autofosforüleerimisega kaasneb kinaasi kahe alamdomeeni nihkumine teineteise suhtes, mis omakorda avab kinaasi domeeni ATP-le. Mitteaktiivses vormis on alamdomeenid ruumiliselt paigutunud nii, et ATP ei pääseks ligi kinaasi katalüütilisele tuumale. Kui kinaasis on mitu fosforüleeritavat aminohapejääki, suureneb kinaasi aktiivsus iga sellise jäägi fosforüleerimisega. Sel juhul on esimese fosforüleerimise näol tegemist cis-autofosforüleerimisega, mis lülitab kinaasi mitteaktiivsest olekust "ooterežiimi".
Retseptoriga seotud türosiinkinaasid
[muuda | muuda lähteteksti]Retseptoriga seotud türosiinkinaasid osalevad mitmetes signaalikaskaadides, sealhulgas tsütokiinide ja kasvuhormoonidega seotud signaaliradades. Üks selline retseptoriga seotud türosiinkinaas on Januse kinaas (JAK), mille efekte kannavad edasi STAT-valgud.
Histidiini-spetsiifilised proteiinkinaasid
[muuda | muuda lähteteksti]Histidiinkinaasid on struktuuri poolest teistest proteiinkinaasidest erinevad ja prokarüootides võtavad need peamiselt osa kahekomponendilistest signaaliülekandemehhanismidest.[15] Esmalt kantakse fosfaatrühm ATP-st üle kinaasis sisalduvale histidiinile ning hiljem kantakse see edasi kas vastuvõtvas domeenis või kinaasis endas asuvale aspartaadile. Tekkiv aspartüülfosfaat osaleb seejärel signaaliülekandes.
Histidiinkinaase leidub ka taimedes, seentes ja eukarüootides. Püruvaadi dehüdrogenaasi kinaaside perekond loomades on struktuuri poolest sarnane histidiinkinaasidega, kuid erinevalt histidiinkinaasidest fosforüleerivad need seriinijääke ja tõenäoliselt ei kasuta histidüülfosfaati vaheühendina.
Segatüübilised kinaasid
[muuda | muuda lähteteksti]Mõned kinaasid on segatüübilise aktiivsusega. Näiteks MEK (MAPKK), mis osaleb MAP-kinaasi kaskaadis, on segatüübiline seriini/treoniini ja türosiini kinaas ning loetakse seetõttu topeltspetsiifiliseks kinaasiks.
Inhibiitorid
[muuda | muuda lähteteksti]Proteiinkinaaside regulatsioonihäired võivad tihti põhjustada haigusi, sealhulgas vähki, sest kinaaside vahendatud signaaliülekande mehhanismid kontrollivad rakkude kasvamist, liikumist ja apoptoosi.[16] Ained, mis inhibeerivad spetsiifilisi kinaase, on seetõttu potentsiaalsed ravimid ning mõned proteiinkinaaside inhibiitorid on ka kliinilises kasutuses. Proteiinkinaaside inhibiitorid jagunevad sidumiskoha järgi kolmeks: ATP-analoogsed, peptiidsed ja bisubstraatsed.
ATP-analoogsed inhibiitorid
[muuda | muuda lähteteksti]ATP-analoogsed proteiinkinaaside inhibiitorid seovad end kinaasi nukleotiide siduvasse taskusse ja takistavad fosforüleerimisreaktsiooni läbiviimist. ATP sidumistasku on erinevatel kinaasidel väga sarnane ja seetõttu pole ATP-analoogsed inhibiitorid kuigi selektiivsed. Samuti peavad ATP-analoogsed inhibiitorid konkureerima ATP-ga, mille kontsentratsioon rakus on kõrge. Sellegipoolest on mitmed kliiniliselt kasutatavad inhibiitorid, näiteks Gleevec ja Iressa, ATP-analoogsed.
Peptiidsed inhibiitorid
[muuda | muuda lähteteksti]Peptiidsed inhibiitorid hõivavad proteiinkinaasi valku siduva tasku. Peptiidsed inhibiitorid on selektiivsemad kui ATP-analoogsed inhibiitorid, kuid mõjutatavad proteaaside poolt ja seetõttu lagunevad organismis kiiremini.[17]
Bisubstraatsed inhibiitorid
[muuda | muuda lähteteksti] Pikemalt artiklis Bisubstraatsed inhibiitorid
Pikemalt artiklis Bisubstraatsed inhibiitorid
Bisubstraatsed inhibiitorid koosnevad ATP-analoogsest ja peptiidsest fragmendist. Selline lähenemine kombineerib ATP-analoogsete inhibiitorite head sidumisomadused peptiidsete inhibiitorite suure selektiivsusega.[18]
Vaata ka
[muuda | muuda lähteteksti]- Proteiinkinaas B
- Proteiinkinaas CK2
- Proteiinkinaas MSK1
- Rho-sõltuv proteiinkinaas
- Tsükliinisõltuvad kinaasid
Viited
[muuda | muuda lähteteksti]- ↑ "Meditsiinisõnastik", tõlkijad Katrin Rehemaa, Sirje Ootsing, Laine Trapido, lk 617, 2004, ISBN 9985-829-55-7
- ↑ Manning G, Whyte DB.; et al. (2002). "The protein kinase complement of the human genome". Science. 298 (5600): 1912–1934. DOI:10.1126/science.1075762. PMID 12471243.
{{cite journal}}: et al.-i üleliigne kasutus kohas:|author=(juhend) - ↑ Krishanpa Anamika, Nicolas Garnier ja Narayanaswamy Srinivasan,Functional diversity of human protein kinase splice variants marks significant expansion of human kinome, BMC Genomics 2009, 10:622 doi:10.1186/1471-2164-10-622, Veebiversioon (vaadatud 27.10.2013) (inglise keeles)
- ↑ Dhanasekaran N, Premkumar Reddy E (september 1998). "Signaling by dual specificity kinases". Oncogene. 17 (11 Reviews): 1447–55. DOI:10.1038/sj.onc.1202251. PMID 9779990.
- ↑ Besant PG, Tan E, Attwood PV (märts 2003). "Mammalian protein histidine kinases". Int. J. Biochem. Cell Biol. 35 (3): 297–309. DOI:10.1016/S1357-2725(02)00257-1. PMID 12531242.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Lochhead, Pamela A (2009). "Protein Kinase Activation Loop Autophosphorylation in Cis: Overcoming a Catch-22 Situation". Science Signaling. 2 (54 Perspectives): pe4. DOI:10.1126/scisignal.254pe4. PMID 19155529.
- ↑ Hanks SK (2003). "Genomic analysis of the eukaryotic protein kinase superfamily: a perspective". Genome Biol. 4 (5): 111. DOI:10.1186/gb-2003-4-5-111. PMC 156577. PMID 12734000. Originaali arhiivikoopia seisuga 19. aprill 2015. Vaadatud 19. novembril 2012.
- ↑ Hanks SK, Hunter T (mai 1995). "Protein kinases 6. The eukaryotic protein kinase superfamily: kinase (catalytic) domain structure and classification". FASEB J. 9 (8): 576–96. PMID 7768349.
- ↑ Hunter T (1991). "Protein kinase classification". Meth. Enzymol. 200: 3–37. DOI:10.1016/0076-6879(91)00125-G. PMID 1835513.
- ↑ Hanks SK, Quinn AM (1991). "Protein kinase catalytic domain sequence database: identification of conserved features of primary structure and classification of family members". Meth. Enzymol. 200: 38–62. DOI:10.1016/0076-6879(91)00126-H. PMID 1956325.
- ↑ Stout TJ, Foster PG, Matthews DJ (2004). "High-throughput structural biology in drug discovery: protein kinases". Curr. Pharm. Des. 10 (10): 1069–82. DOI:10.2174/1381612043452695. PMID 15078142. Originaali arhiivikoopia seisuga 9. detsember 2012. Vaadatud 19. novembril 2012.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Knighton DR, Zheng JH, Ten Eyck LF, Ashford VA, Xuong NH, Taylor SS, Sowadski JM (juuli 1991). "Crystal structure of the catalytic subunit of cyclic adenosine monophosphate-dependent protein kinase". Science. 253 (5018): 407–14. DOI:10.1126/science.1862342. PMID 1862342.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Vlahopoulos, S; Zoumpourlis, VC (august 2004). "JNK: a key modulator of intracellular signaling". Biochemistry. Biokhimiia. 69 (8): 844–54. DOI:10.1023/B:BIRY.0000040215.02460.45. PMID 15377263.
{{cite journal}}: tundmatu tühi parameeter:|author-name-separator=(juhend) - ↑ Higashiyama, Shigeki; Iwabuki, Hidehiko; Morimoto, Chie; Hieda, Miki; Inoue, Hirofumi; Matsushita, Natsuki (veebruar 2008). "Membrane-anchored growth factors, the epidermal growth factor family: Beyond receptor ligands". Cancer Science. 99 (2): 214–20. DOI:10.1111/j.1349-7006.2007.00676.x. PMID 18271917.
{{cite journal}}: tundmatu tühi parameeter:|author-name-separator=(juhend) - ↑ Wolanin PW, Thomason PA, Stock JB (2002). "Histidine protein kinases: key signal transducers outside the animal kingdom". Genome Biology. 3 (10): reviews3013.1–3013.8. DOI:10.1186/gb-2002-3-10-reviews3013. PMC 244915. PMID 12372152. Originaali arhiivikoopia seisuga 26. august 2015. Vaadatud 19. novembril 2012.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Noble, MEM, Endicott, JE, Johnson, LN (2004). "Protein Kinase Inhibitors: Insights into Drug Design from Structure". Science. 303 (5665): 1800–1805. DOI:10.1126/science.1095920. PMID 15031492.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Bogoyevitch, MA, Barr, RK, Ketterman, AJ (2005). "Peptide inhibitors of protein kinases—discovery, characterisation and use". Biochimica et Biophysica Acta (BBA) – Proteins and Proteomics. 1754 (1–2): 79–99. DOI:10.1016/j.bbapap.2005.07.025. PMID 16182621.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Lavõgina D, Enkvist E, Uri A (2010). "Bisubstrate inhibitors of protein kinases: from principle to practical applications". ChemMedChem. 5 (1 Reviews): 23–34. DOI:10.1002/cmdc.200900252. PMID 19774589.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link)
Välislingid
[muuda | muuda lähteteksti]- Dan R Robinson, Yi-Mi Wu ja Su-Fang Lin, The protein tyrosine kinase family of the human genome, 20 November 2000, Volume 19, Number 49, Pages 5548–5557, Veebiversioon (vaadatud 27.10.2013) (inglise keeles)
- Steven K Hanks, Genomic analysis of the eukaryotic protein kinase superfamily: a perspective, Genome Biol. 2003; 4(5): 111, Published online 2003 April 29. doi: 10.1186/gb-2003-4-5-111, PMCID: PMC156577, Veebiversioon (vaadatud 27.10.2013) (inglise keeles)
- Krishanpa Anamika, Nicolas Garnier ja Narayanaswamy Srinivasan,Functional diversity of human protein kinase splice variants marks significant expansion of human kinome, BMC Genomics 2009, 10:622 doi:10.1186/1471-2164-10-622, Veebiversioon (vaadatud 27.10.2013) (inglise keeles)