Heterolisi
Kimikan heterolisia lotura kobalentearen haustura asimetrikoa da, karga desberdineko bi partikula eratzen dituena: anioia eta katioia. Heterolisian jatorrizko loturako bi elektroiak sortutako bi partikuletako batek bakarrik hartuko ditu[1]. Homolisi esaten zaio haustura simetrikoa denean.
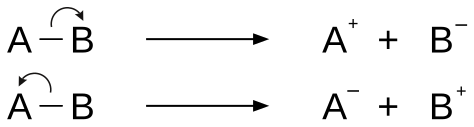
Heterolisia lotura bakunekin soilik gertatzen da.
Heterolisian beharrezkoa den disoziazio-energia homolisian baino txikiago da[2].
| ΔH = 104 kcal/mol | |
| ΔH = 66 kcal/mol (uretan) |
Erreferentziak
[aldatu | aldatu iturburu kodea]- ↑ Chemistry (IUPAC), The International Union of Pure and Applied. «IUPAC - heterolysis (H02809)» goldbook.iupac.org (Noiz kontsultatua: 2023-03-06).
- ↑ Blanksby, Stephen J.; Ellison, G. Barney. (2003-04). «Bond dissociation energies of organic molecules» Accounts of Chemical Research 36 (4): 255–263. doi:. ISSN 0001-4842. PMID 12693923. (Noiz kontsultatua: 2023-03-06).


