ان-فورمیلمتیونین
| N-Formylmethionine | |
|---|---|
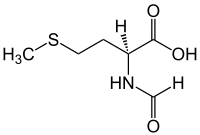
| |
(S)-2-Formylamino-4-methylsulfanylbutanoic acid | |
دیگر نامها 2-Formylamino-4-methylsulfanyl-butyric acid; Formylmethionine; N-Formyl(methyl)homocysteine | |
| شناساگرها | |
| شماره ثبت سیایاس | 4289-98-9 |
| پابکم | 911 |
| شمارهٔ ئیسی | 224-322-8 |
| جیمول-تصاویر سه بعدی | Image 1 |
| |
| خصوصیات | |
| فرمول مولکولی | C6H11NO3S |
| جرم مولی | ۱۷۷٫۲۲ g mol−1 |
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |
| | |
| Infobox references | |
|
| |
N-فورمیلمتیونین (به انگلیسی: N-Formylmethionine) که با نام های fMet[۱] یا HCO-Met[۲] و یا For-Met[۳] نیز شناخته می شود یکی از مشتقات آمینواسید متیونین است که در آن یک گروه فورمیل به گروه آمینو از متیونین متصل شده است. به طور اختصاصی این مولکول برای آغاز فرآیند سنتز پروتئین از ژن های باکتریایی و اندامک ها استفاده می شود و ممکن است پس از ترجمه حذف گردد.
fMet نقشی اساسی و مهم را در فرایند سنتز پروتئین در باکتری ها، میتوکندری ها و کلروپلاست ها ایفا می کند. این مولکول در سنتز سیتوزولی پروتئین در یوکاریوتها، جایی که ژن های هسته ای ترجمه می شوند، کارایی ندارد. فورمیل متیونین همچنین در آرکی ها هم فاقد عملکرد است. در بدن انسان، fMet به عنوان ماده ای خارجی توسط سیستم ایمنی شناسایی می شود و یا مانند هشدار خطری از سلول های آسیب دیده آزاد می شود و موجب القای پاسخ ایمنی بدن نسبت به مبارزه با عامل عفونی می شود.
عملکرد در سنتز پروتئین
[ویرایش]ترجمه
[ویرایش]فورمیل متیونین جهت شروع کارآمد سنتز پروتئین در اکثر گروه های باکتریها مورد نیاز است. کمپلکس 30S ریبوزوم و mRNA به طور اختصاصی و طبیعی tRNAهای متصل به fMet را (tRNAfMet) به کار می گیرد.[۴]
بدلیل اینکه fMet شروع ترجمه را هدایت می کند، پروتئین های باکتریایی در انتهای N-terminal خود، با رزیدوی فورمیل متیونین به جای متیونین آغاز می شوند. حضور کدون های دیگر AUG در مرحله طویل سازی ترجمه، منجر به قرارگیری متیونین طبیعی (و نه فورمیل متیونین) در ساختار پروتئین میشود زیرا از tRNAهای مرحله طویل سازی که متصل به متیونین هستند استفاده می شود.[۴]
اضافه شدن گروه فورمیل به متیونین توسط آنزیم متیونیل-tRNA فورمیل ترانسفراز کاتالیز می شود. این تغییر شیمیایی پس از بارگیری متیونین طبیعی بر روی tRNAfMet که توسط آنزیم آمینواسیل-tRNA سنتتاز رخ می دهد، انجام می گردد. متیونین طبیعی می تواند هم بر روی tRNAfMet و هم بر روی tRNAMet بارگیری شود؛ با اینحال آنزیم فورمیلترانسفراز تنها اضافه شدن گروه فورمیل به متیونینی که روی tRNAfMet بارگیری شده است را کاتالیز می کند و نه بر روی tRNAMet؛ زیرا آنزیم فورمیلترانسفراز ویژگی های خاصی را از tRNAfMet شناسایی می کند.[۴]
میتوکندری های سلول های یوکاریوتی مانند سلول های انسانی و کلروپلاست های سلول های گیاهی نیز سنتز پروتئین خود را با fMet آغاز می کنند. این واقعیت که شروع ترجمه میتوکندری و کلروپلاست مانند باکتری ها توسط fMet هدایت می شود، مدرکی دیگر بر نظریه درونهمزیستی میتوکندری و کلروپلاست است.[۵]
برخلاف انتظار، فورمیلترانسفراز همچنین می تواند بر روی tRNA آغازگر در سلول های یوکاریوتی مخمر اثرگذار باشد. اما حتی تحت شرایط طبیعی در سلول های یوکاریوتی دیگر، آنزیم فورمیلترانسفراز کد شده از هسته به طور کامل وارد میتوکندری نمی شود و در سیتوزول تحت استرس باقی می ماند. این فورمیلترانسفرازهای سیتوزولی fMet-tRNA را تولید کرده که می توانند در ریبوزوم های سیتوزولیک به کار گرفته شوند و تولید پروتئین هایی با fMet در انتهای N-ترمینال کنند. البته این پروتئین ها برای تخریب توسط فرایندهای خاص درون سلولی هدف گذاری می شوند.[۶]
پردازش بیشتر
[ویرایش]انتهای N-ترمینال حاوی fMet در اکثر پروتئین ها چه میزبان و چه نوترکیب توسط دو واکنش آنزیمی، حذف می شود. اولین واکنش، توسط آنزیم پپتید دفورمیلاز (PDF) انجام می شود که fMet را دفورمیله کرده و رزیدوی ابتدایی را به فرم نرمال متیونین باز می گرداند. سپس در واکنش دوم، آنزیم متیونین آمینوپپتیداز (MetAP) رزیدوی متیونین را از زنجیره حذف می کند.[۷] اگر انتهای N-ترمینال حاوی fMet توسط آنزیم PDF حذف نشود، بعنوان یک دگرون (degron) یعنی سیگنالی برای تخریب پروتئین، عمل می کند.[۸]
تنوع
[ویرایش]گروه فورمیل، آنچنان زیاد هم برای شروع سنتز پروتئین ضروری نیست! باکتری هایی که ژن فورمیلترانسفراز آنها بیان نمی شود و اجازه تبدیل Met-tRNAfMet به fMet-tRNAfMet را نمی دهد، می توانند درجات متفاوتی از توانایی ادامه سنتز پروتئین بدون فورمیل متیونین را داشته باشند. باکتری هایی مانند E. coli و S. pneumoniae و B. subtilis توانایی ترجمه خود را بدون حضور آنزیم فورمیلترانسفراز از دست می دهند در حالیکه P. aeruginosa و S. aureus وH. influenzae و احتمالا S. faecalis حتی در عدم حضور آنزیم فورمیلترانسفراز می توانند مقدار زیادی پروتئین تولید کنند. در باکتری P. aeruginosa، این توانایی توسط فاکتور آغازگر باکتریایی 2، که می تواند هر دو کمپلکس Met-tRNAfMet و fMet-tRNAfMet را به ریبوزوم هدایت کند، تسهیل می شود.[۹]
ارتباط با ایمونولوژی
[ویرایش]بدلیل اینکه fMet در پروتئین های سنتز شده توسط باکتری ها و نه در یوکاریوت ها حضور دارد (البته به غیر از اندامک های منشا گرفته از باکتری ها)، سیستم ایمنی ممکن است از آن برای تشخیص خودی و بیگانه کمک بگیرد. سلول های پلیمورفونوکلئر (مانند نوتروفیل ها) می توانند به پروتئین هایی که با fMet آغاز می شوند، متصل شود و از آنها جهت جذب لوکوسیت های گردش خون و القای فعالیت های میکروب کشی در آنها مانند فاگوسیتوز استفاده کند.[۱۰][۱۱]
از آنجایی که fMet در پروتئین هایی که توسط میتوکندری ها و کلروپلاست ها نیز حضور دارد، نظریه های اخیر بر این باورند که این مولکول به عنوان عامل شناسایی خودی و بیگانه توسط سیستم ایمنی عمل نمی کند. به جای آن، الیگوپپتیدها و پروتئینهای حاوی fMet توسط میتوکندریهای بافت آسیب دیده همانند باکتری های آسیب دیده آزاد شده و می توانند به عنوان یک سیگنال هشدار عمل کنند؛ همانگونه که در مدل خطر ایمنی مورد بحث قرار گرفت. نمونه اولیه الیگوپپتید حاوی fMet مولکول N-فورمیلمتیونین-لوسیل-فنیلآلانین یا FMLP می باشد که لوکوسیت ها و دیگر انواع سلولی را با اتصال به گیرنده فورمیل پپتید 1 یا FPR1 و گیرنده فورمیل پپتید 2 یا FPR2 که گیرنده های سطحی این سلول ها هستند، فعال می کند. با فعالیت در راستای این گیرنده ها، الیگوپپتیدها و پروتئین های حاوی fMet بخشی از سیستم ایمنی ذاتی هستند؛ آنها با عملکرد خود موجب شروع پاسخ های التهابی حاد شده ولی در دیگر شرایط می توانند موجب مهار و برطرف کردن این پاسخ ها شوند. الیگوپپتیدها و پروتئینهای حاوی fMet همچنین در دیگر پاسخ های فیزیولوژیکی و پاتولوژیکی دخیل هستند.
جستارهای وابسته
[ویرایش]منابع
[ویرایش]- ↑ PubChem. "N-Formyl-DL-methionine". pubchem.ncbi.nlm.nih.gov (به انگلیسی). Retrieved 2024-06-27.
- ↑ «3AA-18 and 3AA-19». iupac.qmul.ac.uk. دریافتشده در ۲۰۲۴-۰۶-۲۷.
- ↑ «3AA-18 and 3AA-19». iupac.qmul.ac.uk. دریافتشده در ۲۰۲۴-۰۶-۲۷.
- ↑ ۴٫۰ ۴٫۱ ۴٫۲ Shetty, Sunil; Shah, Riyaz A.; Chembazhi, Ullas V.; Sah, Shivjee; Varshney, Umesh (2016-09-26). "Two highly conserved features of bacterial initiator tRNAs license them to pass through distinct checkpoints in translation initiation". Nucleic Acids Research (به انگلیسی): gkw854. doi:10.1093/nar/gkw854. ISSN 0305-1048. PMC 5389676. PMID 28204695.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ "Molecular biology of the cell | WorldCat.org". search.worldcat.org (به انگلیسی). Retrieved 2024-06-27.
- ↑ Varshavsky, Alexander (2019-01-08). "N-degron and C-degron pathways of protein degradation". Proceedings of the National Academy of Sciences (به انگلیسی). 116 (2): 358–366. doi:10.1073/pnas.1816596116. ISSN 0027-8424. PMC 6329975. PMID 30622213.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Sherman, Fred; Stewart, John W.; Tsunasawa, Susumu (1985-07). "Methionine or not methionine at the beginning of a protein". BioEssays (به انگلیسی). 3 (1): 27–31. doi:10.1002/bies.950030108. ISSN 0265-9247.
{{cite journal}}: Check date values in:|date=(help) - ↑ Piatkov, Konstantin; Vu, Tri; Hwang, Cheol-Sang; Varshavsky, Alexander (2015-10-05). "Formyl-methionine as a degradation signal at the N-termini of bacterial proteins". Microbial Cell. 2 (10): 376–393. doi:10.15698/mic2015.10.231. PMC 4745127. PMID 26866044.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Piatkov, Konstantin; Vu, Tri; Hwang, Cheol-Sang; Varshavsky, Alexander (2015-10-05). "Formyl-methionine as a degradation signal at the N-termini of bacterial proteins". Microbial Cell. 2 (10): 376–393. doi:10.15698/mic2015.10.231. PMC 4745127. PMID 26866044.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Detmers, P A; Wright, S D; Olsen, E; Kimball, B; Cohn, Z A (1987-09-01). "Aggregation of complement receptors on human neutrophils in the absence of ligand". The Journal of cell biology (به انگلیسی). 105 (3): 1137–1145. doi:10.1083/jcb.105.3.1137. ISSN 0021-9525. PMC 2114803. PMID 2958480.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ «The Innate Immune System: Pattern-Recognition Receptors, Antigen-Nonspecific Antimicrobial Body Molecules, and Cytokines». web.archive.org. ۲۰۱۰-۰۷-۲۷. بایگانیشده از اصلی در ۲۷ ژوئیه ۲۰۱۰. دریافتشده در ۲۰۲۴-۰۶-۲۷.
- «IUPAC GOLD BOOK». دریافتشده در ۱۸ مارس ۲۰۱۲.