اپرمیلاست
 | |
 | |
| دادههای بالینی | |
|---|---|
| تلفظ | /əˈprɛmɪlæst/ ə-PREM-i-last |
| نامهای تجاری | Otezla |
| نامهای دیگر | CC-10004 |
| AHFS/Drugs.com | entry |
| مدلاین پلاس | a614022 |
| دادهها | |
| ردهبندی داروهای بارداری |
|
| روش مصرف دارو | by mouth (قرص) |
| کد ATC | |
| وضعیت قانونی | |
| وضعیت قانونی |
|
| دادههای فارماکوکینتیک | |
| زیست فراهمی | 73%;[۱] Tmax = ~2.5 hours |
| پیوند پروتئینی | ~68%[۱] |
| متابولیسم | کبد (CYP3A4, with minor contributions from CYP2A6, CYP1A2)[۱] |
| متابولیتها | O-desmethylapremilast گلوکورونید (and others)[۲] |
| نیمهعمر حذف | 6–9 hours[۱] |
| دفع | Urine (58%), faeces (39%)[۱] |
| شناسهها | |
| |
| شمارهٔ سیایاس | |
| پابکم CID | |
| دراگبنک | |
| کماسپایدر | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.234.786 |
| دادههای فیزیکی و شیمیایی | |
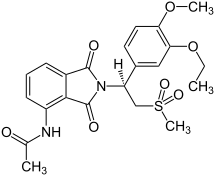
| فرمول شیمیایی | C22H24N2O7S |
| جرم مولی | 460.500 g/mol g·mol−1 |
| مدل سه بعدی (جیمول) | |
| |
| |
اپرمیلاست (به انگلیسی: Apremilast) (با نام تجاری Otezla[۳]) یک مهارکنندهٔ خوراکی مولکولهای کوچک فسفودیاستراز ۴ (PDE4) میباشد. اپرمیلاست به طور خاص PDE4 را مهار و با تولید خود به خود از TNF-آلفا از سلولهای سینوویال روماتوئید انسانی جلوگیری میکند.[۴] این فعالیت ضد التهابی است.
استفادهٔ پزشکی
[ویرایش]اپرمیلاست توسط USFDA در مارس ۲۰۱۴ برای درمان بزرگسالان مبتلا به ورم مفاصل پسوریاتیک فعال تصویب شد.[۵] اپرمیلاست اولین داروی خوراکی است که مورد تایید FDA برای درمان ورم مفاصل پسوریاتیک ارائه میشود و یک درمان خوراکی راحت در مقایسه با داروهای بیولوژیک تزریقی میباشد.[۶] در سپتامبر ۲۰۱۴، Otezla (apremilast) ،USFDA را برای درمان پسوریازیس پلاکی متوسط تا وخیم تایید کرده است.[۷] همچنین برای اثر بخشی آن در درمان دیگر بیماریهای مزمن التهابی مانند اسپوندیلیت انکیلوزان، بیماری بهجت و آرتریت روماتوئید تست شده است.
پانویس
[ویرایش]- ↑ ۱٫۰ ۱٫۱ ۱٫۲ ۱٫۳ ۱٫۴ "Otezla (aprelimast) dosing, indications, interactions, adverse effects, and more". Medscape Reference. WebMD. Retrieved 28 March 2014.
- ↑ خطای یادکرد: خطای یادکرد:برچسب
<ref> غیرمجاز؛ متنی برای یادکردهای با نامACوارد نشده است. (صفحهٔ راهنما را مطالعه کنید.). - ↑ "Celgene Corporation Announces 2014 Financial Outlook and Preliminary 2013 Results" (Press release). Celgene Corporation. 13 January 2014. Retrieved 2014-01-21.[پیوند مرده]
- ↑ Apremilast
- ↑ FDA approves Otezla to treat psoriatic arthritis
- ↑ Apremilast for the Treatment of Psoriatic Arthritis American College of Rheumatology (14 June 2014). Retrieved 29 October 2014.
- ↑ "Oral Otezla (apremilast) Approved by the U.S. Food and Drug Administration for the Treatment of Patients with Moderate to Severe Plaque Psoriasis" (Press release). Celgene Corporation. 23 September 2014. Retrieved 29 October 2014.