ریتوکسیمب
 | |
| پادتن مونوکلونال | |
|---|---|
| گونه | Whole antibody |
| منبع | Chimeric (موش/انسان) |
| هدف | CD20 |
| دادههای بالینی | |
| نامهای تجاری | ریتوکسان، مَـبترا، نامهای دیگر[۱] |
| نامهای دیگر | rituximab-abbs, rituximab-pvvr, rituximab-arrx[۲] |
| AHFS/Drugs.com | monograph |
| مدلاین پلاس | a607038 |
| دادهها | |
| ردهبندی داروهای بارداری | |
| روش مصرف دارو | تزریق وریدی |
| گروه دارویی | پادتن مونوکلونال |
| کد ATC | |
| وضعیت قانونی | |
| وضعیت قانونی |
|
| دادههای فارماکوکینتیک | |
| زیست فراهمی | ۱۰۰٪ (وریدی) |
| نیمهعمر حذف | ۳۰ تا ۴۰۰ ساعت (بر حسب دوز و طولِ درمان متفاوت است) |
| دفع | نامشخص: احتمالاً در درون شبکه آندوپلاسمی دچار فاگوسیتوز و کاتابولیسم میشود. |
| شناسهها | |
| شمارهٔ سیایاس | |
| دراگبنک | |
| کماسپایدر |
|
| UNII | |
| KEGG | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.224.382 |
| دادههای فیزیکی و شیمیایی | |
| فرمول شیمیایی | C6416H9874N1688O1987S44 |
| جرم مولی | ۱۴۳۸۶۰٫۰۴ g·mol−1 |
| | |
ریتوکسیمَب (انگلیسی: Rituximab) دارویی است که جهت درمان برخی انواع بیماریهای خودایمنی و سرطانها بکار میرود.[۴]
این دارو در درمان لنفوم غیرهاجکین، لوسمی مزمن لنفاوی (CLL)، روماتیسم مفصلی، گرانولوماتوز وگنر، پورپورای ایمنی با کاهش پلاکتها، پمفیگوس ولگاریس، میاستنی گراویس و زخمهای مخاطی-دهانی ناشی از ویروس اپشتین–بار کاربرد دارد[۴][۵][۶][۷] و بهطریقهٔ تزریق وریدی آهسته تجویز میشود.[۴]
عوارض نسبتاً شایع که اغلب ظرف ۲ ساعت از آغاز تزریق به وجود میآیند، شامل راش پوستی، خارش، فشار خون پایین و تنگی نفس است.[۴] باقی عوارض که ممکن است شدید باشد، شامل «فعالشدنِ دوبارهٔ هپاتیت ب» در آنهایی که سابقهٔ ابتلا به این بیماری را داشتهاند، «لکوانسفالوپاتی چندکانونی پیشرونده» (PML) و «نکرولیز سمی پوستی» است.[۴][۸] هنوز معلوم نیست که مصرف این دارو در دوران بارداری چه تأثیراتی بر جنین دارد.[۴][۳]
این دارو یک پادتن مونوکلونال کایمریک علیه پروتئین CD20 است که عموماً بر روی سطحِ لنفوسیتهای B یافت میشود.[۹] ریتوکسیمب با اتصال به «CD20»، موجب مرگ سلولی میشود.[۴]
ریتوکسیمب در سال ۱۹۹۷ میلادی برای مصارف پزشکی مورد تأیید واقع شد.[۹] این دارو جزءِ داروهای ضروری سازمان جهانی بهداشت است که در واقع داروهای بسیار مؤثر و کمخطر در سیستم بهداشتی محسوب میشوند.[۱۰] حق امتیاز انحصاری این دارو در سال ۲۰۱۶ منقضی شد و اینک داروهای ژنریک مشابه در دسترس است.[۱۱]
مصارف پزشکی
[ویرایش]بهطور خلاصه، ریتوکسیمب هم لنفوسیتهای بی سالم و هم لنفوسیتهای بی سرطانی را که دارای CD20 است، تخریب میکند. این دارو در ترکیب با فلودارابین و سیکلوفسفامید در درمان لوسمی مزمن لنفاوی به کار میرود.[۱۲] ریتوکسیمب با متوترکسات در درمان روماتیسم مفصلی متوسط تا شدید که به درمانهای پیشین ضد TNF پاسخ ندادهاند، تجویز میشود.[۱۲] ریتوکسیمب در ترکیب با گلوکوکورتیکوئید برای درمان «پلیآنژیت میکروسکوپی» استفاده میشود.[۱۲]
ریتوکسیمب در ترکیب با هیالورونیداز انسانی که با نامهای مَـبترا اسسی و «ریتوکسین هایسلا» عرضه میشود،[۱۳] برای درمان «لنفوم فولیکولار منتشر سلولهای بی» و «لوسمی مزمن لنفاوی» تجویز میگردد.[۱۴]
سرطانهای خون
[ویرایش]از ریتوکسیمب در درمان سرطانهای گلبولهای سفید (لوکمیها و لنفومها) همچون لنفوم غیرهاجکین، لوسمی مزمن لنفاوی (CLL) و لنفوم هاجکین (از نوع لنفوسیتهای غالب)[۱۵] و همچنین ماکروگلوبولینمی والدنشتروم استفاده میشود.[۴]
بیماریهای خودایمنی
[ویرایش]طی ۳ کارآزمایی تصادفی کنترلشده مشاهده گردید که ریتوکسیمب در درمان آرتریت روماتوئید مؤثر است و اینک مجوز مصرف در موارد مقاوم این بیماری را داراست.[۱۶] در ایالات متحده آمریکا، سازمان غذا و دارو ریتوکسیمب را در ترکیب با متوترکسات (MTX) برای کاهش علائم و نشانههای بیماران بالغ مبتلا به آرتریت روماتوئید متوسط تا شدیدی که به درمان با داروهای ضد فاکتور نکروز توموری آلفا پاسخی ندادهاند، مورد پذیرش قرار دادهاست. در اروپا این مجوز فقط برای موارد شدید این بیماری که به درمانهای ضد TNF پاسخی ندادهاند، تأیید شدهاست.[۱۷]
شواهدی مبنی بر کارایی (و نه لزوماً بیخطری) این دارو در زمینهٔ درمان برخی بیماریهای خودایمنی موجود است و ریتوکسیمب بهطور خارجازدستور (Off-label) برای درمان موارد شدید اماس،[۱۸][۱۹] لوپوس منتشر، پلینوروپاتی دمیلینهکنندهٔ التهابی مزمن و کمخونیهای خودایمنی بهکار میرود.[۲۰] خطرناکترین و البته یکی از نادرترین عوارض این دارو، لکوانسفالوپاتی چندکانونی پیشرونده (PML) است که اغلب مرگبار است، اما تعداد بسیار اندکی از موارد این بیماری در جریان بیماریهای خودایمنی ثبت شدهاست.[۲۰][۲۱]
سایر بیماریهای خودایمنی که در درمانشان از ریتوکسیمب استفاده شدهاست، شامل کمخونی همولیتیک خودایمنی، اریتروبلاستوپنی، پورپورای ترومبوتیک ترومبوسیتوپنیک،[۲۲] پورپورای ایمنی با کاهش پلاکتها،[۲۳][۲۴] سندرم ایوانس،[۲۵] واسکولیتها (مثلاً گرانولوماتوز وگنر)، اختلالات تاولی پوست (مثلاً پمفیگوس و پمفیگوئید با نتایج بسیار امیدوارکننده طی یک پژوهش در سال ۲۰۰۶ که ۸۵٪ بهبودی فوری را در پمفیگوس نشان داد)،[۲۶] دیابت نوع ۱، سندرم شوگرن، انسفالیت ضد گیرندهٔ انامدیای، سندرم دویک،[۲۷] افتالموپاتی گریوز،[۲۸] پانکراتیت خودایمنی،[۲۹] سندرم اُپوسکلونوس میوکلونوس[۳۰] و بیماری مرتبط با IgG4 است.[۳۱] برخی شواهد نشان میدهد که ریتوکسیمب در درمان بیماریهای خودایمنی با واسطهٔ IgA کارایی چندانی ندارد.[۳۲]
ریتوکسیمب بهطور خارجازدستور در مدیریت درمانی پیوند کلیه (مثلاً عدم هماهنگی گروه خونی) کاربرد دارد. ریتوکسیمب در درمان القایی پیوند کلیه در افراد بهشدت حساس به کار میرود.
عوارض جانبی
[ویرایش]عوارض جدی که ممکن است موجب ناتوانی و مرگ شوند عبارتند از:[۱۲][۴]
- واکنشهای شدید تزریق وریدی (ظرف ۲۴ ساعت پس از تزریق - ۸۰٪ موارد پس از دوز اول دارو بوده است).
- ایست قلبی
- سندرم آزادسازی سیتوکین
- سندرم لیز توموری که موجب نارسایی حاد کلیه میشود.
- عفونت
- فعالشدن دوبارهٔ هپاتیت ب
- عفونتهای ویروسی دیگر
- لکوانسفالوپاتی چندکانونی پیشرونده به سبب فعال شدن مجدد ویروس جیسی[۳۳]
- سمیت ایمنی با کاهش ۷۰٪ تا ۸۰٪ لنفوسیتهای بی در مبتلایان به لنفوم
- سمیت ریوی[۳۴]
- انسداد روده با احتمال پارهشدن روده[۳۵]
دو بیمار مبتلا به لوپوس منتشر به دنبال درمان با ریتوکسیمب دچار لکوانسفالوپاتی چندکانونی پیشرونده و مرگ شدند. این بیماری نادر به دلیل فعال شدن مجدد ویروس جیسی که نوعی ویروس شایع و خاموش در مغز است، ایجاد میشود. فعال شدن این ویروس خاموش سبب آسیب شدید مغزی و مرگ میگردد.[۳۶]
دستکم یک بیمار مبتلا به آرتریت روماتوئید پس از درمان با ریتوکسیمب دچار لکوانسفالوپاتی چندکانونی پیشرونده شد.[۳۷]
ریتوکسیمب احتمالاً یکی از کوفاکتورهای ایجاد هپاتیت ئی مزمن در یکی از مبتلایان به لنفوم بود. هپاتیت ئی معمولاً یک بیماری حاد است و این موضوع نشان میدهد که این دارو در کنار اثرِ خودِ لنفوم، سبب تضعیف سیستم ایمنی بدن در پاسخدهی به ویروس شدهاست.[۳۸]
نحوهٔ عملکرد دارو
[ویرایش]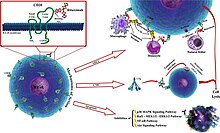

ریتوکسیمب به پروتئینهای CD20 سطح سلول متصل میشود. این مولکول بر سطح لنفوسیتهای بی جوان و نابالغ و در تمامی مراحل تمایز آن دیده میشود، بهجز پلاسماسلها. با آنکه وظیفه CD20 بهطور دقیق روشن نیست، اما احتمال دارد در درونریزی یون کلسیم از خلال غشا پلاسمایی و حفظ غلظت درونسلولی آن و فعال کردن لنفوسیتهای بی نقش داشته باشد.
ریتوکسیمب در حذف سلولهایی که مقادیر اندکی CD20 دارند، چندان مؤثر نیست. این دارو به یک سمت «لنفوسیت بی» که حاوی CD20 است رفته و یک سرپوش ایجاد نموده و سایر پروتئینها را به آن سو میکشاند. این سرپوش، کارامدی یاختههای کشنده طبیعی (NK) را در تخریب «لنفوسیتهای بی» تغییر میدهد، به نحوی که با اتصال به این سرپوش، با احتمال ۸۰٪ «لنفوسیتهای بی» را میکشد. در مقایسه اگر ریتوکسیمب این سرپوش نامتقارن را ایجاد نکند، میزان موفقیت یاختههای کشنده طبیعی در کشتن «لنفوسیتهای بی» تنها ۴۰٪ است.[۴۰][۴۱]
اثرهای زیر از ریتوکسیمب مشاهده است:[۴۲]
- ناحیه قطعه کریستالیزهشونده ریتوکسیمب، «سمیت سلولی وابسته به پادتن» و «سمیت سلولی وابسته به کمپلمان» را واسطهگری میکند.
- ریتوکسیمب یک اثر کلی تنظیمی در چرخه سلول دارد.
- اثر ترجیحی در کشتن لنفوسیتهای B که حاوی مقادیر فراوان CD20 و همچنین میل به پیامرسانی BCR باشند، بهویژه در لوسمی مزمن لنفاوی (CLL).
- ریتوکسیمب، مجموعه سازگاری بافتی اصلی کلاس دو و همچنین مولکولهای چسبندگی LFA-1 و LFA-3 را افزایش میدهد.
- ریتوکسیمب باعث ریزش CD23 میشود.
- میزان گیرندههای لنفوسیت بی (BCR) را کاهش میدهد.
- آپوپتوز سلولهای حاوی CD20 را موجب میشود.
مجموعهٔ اثرهای بالا در نهایت به حذف لنفوسیتهای بی (از جمله انواع سرطانی آنها) از بدن منجر میشود و این اجازه را میدهد که لنفوسیتهای جوان و سالم از یاختههای بنیادی لنفوئیدی تولید و جایگزین آنها شوند.
ریتوکسیمب به اسیدهای آمینه ۱۷۰ تا ۱۷۳ و ۱۸۲ تا ۱۸۵ از مولکول CD20 متصل میشود که به سبب پیوند دیسولفید میان ۱۶۷ و ۱۸۳، فاصله اندکی از یکدیگر دارند.[۴۳]
تاریخچه
[ویرایش]ریتوکسیمب توسط «نبیل هانا»، «میشل رِف» و همکاران پژوهشگرشان در بایوژن با نامِ اولیهٔ IDEC-C2B8 ساخته شد. مجوز انحصاری تولید این دارو در سال ۱۹۹۸ صادر و در ۲۰۱۶ میلادی منقضی شد.[۴۴]
به سبب اثربخشی و بیخطری این دارو در کارآزماییهای بالینی،[۴۵] سازمان غذا و داروی آمریکا در سال ۱۹۹۷ برای درمان لنفومهای «غیر هاجکین لنفوسیت بی» که به سایر انواع شیمیدرمانی پاسخ ندادهاند، مورد تأیید قرار گرفت.[۴۶] ترکیب ریتوکسیمب و رژیم شیمیدرمانی CHOP در «لنفوم گستردهٔ لنفوسیتهای بی» و بسیاری از انواع «لنفومهای سلول بی» مؤثرتر از رژیم CHOP بهتنهایی است.[۴۷] کمیسیون اروپا این دارو را در سال ۲۰۱۰ برای درمان نگهدارندهٔ «لنفوم فولیکولار» پس از انجام درمانهای اولیه آن، تأیید کرد.[۴۸]
بازاریابی این دارو در ایالات متحده آمریکا توسط شرکتهای بایوژن و جننتک و در اتحادیه اروپا و کانادا توسط شرکت هوفمان-لا روش انجام میشود.
ریتوکسیمب یکی از داروهای ضروری سازمان جهانی بهداشت است.[۱۰]
این دارو که در سال ۲۰۱۶ به صورت تزریق وریدی (ظرف ۲٫۵ ساعت) در دسترس بود، جهت درمان لوسمی مزمن لنفاوی به صورت تزریق زیرجلدی هم مورد پذیرش واقع شد.[۴۹]
حق انحصاری تولید این دارو در فوریه ۲۰۱۳ در اروپا و در سپتامبر ۲۰۱۶ در آمریکا منقضی شد.[۵۰] تا نوامبر ۲۰۱۸ میلادی، چندین داروی ژنریک مشابه در اتحادیهٔ اروپا، سوئیس، ژاپن و استرالیا در دسترس است.[۵۱][۵۰][۵۲]
منابع
[ویرایش]- ↑ Drugs.com International brand names for rituximab بایگانیشده در ۲۰۱۶-۰۴-۲۲ توسط Wayback Machine Page accessed 1 April 2016
- ↑ "Riabni : FDA-Approved Drugs". U.S. Food and Drug Administration (FDA). Retrieved 17 December 2020.
- ↑ ۳٫۰ ۳٫۱ ۳٫۲ "Rituximab Use During Pregnancy". Drugs.com. 16 December 2019. Retrieved 2 February 2020.
- ↑ ۴٫۰ ۴٫۱ ۴٫۲ ۴٫۳ ۴٫۴ ۴٫۵ ۴٫۶ ۴٫۷ ۴٫۸ "Rituximab". The American Society of Health-System Pharmacists. Archived from the original on 27 March 2016. Retrieved 8 December 2016.
- ↑ Tandan, Rup; Hehir, Michael K.; Waheed, Waqar; Howard, Diantha B. (August 2017). "Rituximab treatment of myasthenia gravis: A systematic review". Muscle & Nerve. 56 (2): 185–196. doi:10.1002/mus.25597. ISSN 1097-4598. PMID 28164324. S2CID 19504332.
- ↑ Singer, O; McCune, WJ (May 2017). "Update on maintenance therapy for granulomatosis with polyangiitis and microscopic polyangiitis". Current Opinion in Rheumatology. 29 (3): 248–253. doi:10.1097/BOR.0000000000000382. PMID 28306595. S2CID 35805200.
- ↑ Dojcinov SD, Fend F, Quintanilla-Martinez L (March 2018). "EBV-Positive Lymphoproliferations of B- T- and NK-Cell Derivation in Non-Immunocompromised Hosts". Pathogens (Basel, Switzerland). 7 (1): 28. doi:10.3390/pathogens7010028. PMC 5874754. PMID 29518976.
- ↑ "Boxed Warning and new recommendations to decrease risk of hepatitis B". U.S. Food and Drug Administration (FDA). 13 January 2017. Retrieved 2 February 2020.
- ↑ ۹٫۰ ۹٫۱ Bosch, Xavier; Ramos-Casals, Manuel; Khamashta, Munther A. (2013). Drugs Targeting B-Cells in Autoimmune Diseases (به انگلیسی). Springer Science & Business Media. pp. 1–4. ISBN 9783034807067. Archived from the original on 2017-11-05.
- ↑ ۱۰٫۰ ۱۰٫۱ World Health Organization (2019). World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ↑ "Rituximab Biosimilars Shown to Be Safe and Effective". www.medscape.com. Archived from the original on 15 March 2018. Retrieved 29 November 2017.
- ↑ ۱۲٫۰ ۱۲٫۱ ۱۲٫۲ ۱۲٫۳ "Rituxan- rituximab injection, solution". DailyMed. 6 November 2019. Retrieved 2 February 2020.
- ↑ "MabThera SC / Rituxan Hycela (rituximab hyaluronidase)". Roche. Archived from the original on 3 August 2020. Retrieved 9 August 2020.
- ↑ "Rituxan Hycela- rituximab and hyaluronidase injection, solution". DailyMed. 3 December 2019. Retrieved 2 February 2020.
- ↑ Saini KS, Azim HA Jr, Cocorocchio E, Vanazzi A, Saini ML, Raviele PR, Pruneri G, Peccatori FA (2011). "Rituximab in Hodgkin lymphoma: Is the target always a hit?". Cancer Treat Rev. 37 (5): 385–90. doi:10.1016/j.ctrv.2010.11.005. PMID 21183282.
- ↑ Edwards J, Szczepanski L, Szechinski J, Filipowicz-Sosnowska A, Emery P, Close D, Stevens R, Shaw T (2004). "Efficacy of B-cell-targeted therapy with rituximab in patients with rheumatoid arthritis". N Engl J Med. 350 (25): 2572–81. doi:10.1056/NEJMoa032534. PMID 15201414.
- ↑ Tak PP, Kalden JR (2011). "Advances in rheumatology: new targeted therapeutics". Arthritis Research & Therapy. 13 (Suppl 1): S5. doi:10.1186/1478-6354-13-S1-S5. PMC 3123966. PMID 21624184.
- ↑ McGinley, MP; Moss, BP; Cohen, JA (January 2017). "Safety of monoclonal antibodies for the treatment of multiple sclerosis". Expert Opinion on Drug Safety. 16 (1): 89–100. doi:10.1080/14740338.2017.1250881. PMID 27756172. S2CID 36762194.
- ↑ He, Dian; Guo, Rui; Zhang, Fubo; Zhang, Chao; Dong, Shuai; Zhou, Hongyu (2013-12-06). "Rituximab for relapsing-remitting multiple sclerosis". The Cochrane Database of Systematic Reviews (12): CD009130. doi:10.1002/14651858.CD009130.pub3. ISSN 1469-493X. PMID 24310855.
- ↑ ۲۰٫۰ ۲۰٫۱ Paul, Marla (20 May 2009). "Popular Cancer Drug Linked to Often Fatal 'Brain Eating' Virus". Northwestern University News and Information. Archived from the original on 29 May 2010. Retrieved 2009-05-22.
- ↑ "FDA Warns of Safety Concern Regarding Rituxan in New Patient Population". U.S. Food and Drug Administration (FDA) (Press release). 18 December 2006. Archived from the original on 2009-05-13. Retrieved 2013-04-29.
- ↑ Froissart A, Veyradier A, Hié M, Benhamou Y, Coppo P (August 2015). "Rituximab in autoimmune thrombotic thrombocytopenic purpura: A success story". Eur J Intern Med. 26 (9): 659–65. doi:10.1016/j.ejim.2015.07.021. PMID 26293834.
- ↑ Braendstrup P, Bjerrum OW, Nielsen OJ, et al. (April 2005). "Rituximab chimeric anti-CD20 monoclonal antibody treatment for adult refractory idiopathic thrombocytopenic purpura". Am. J. Hematol. 78 (4): 275–80. doi:10.1002/ajh.20276. PMID 15795920. S2CID 42218074.
- ↑ Patel V, Mihatov N, Cooper N, Stasi R, Cunningham-Rundles S, Bussel JB (2007). "Long-term responses seen with rituximab in patients with ITP" (PDF). Community Oncology. 4 (2): 107. doi:10.1016/s1548-5315(11)70061-4. Archived from the original (PDF) on 2007-09-29. Retrieved 2007-04-18.
- ↑ Shanafelt TD, Madueme HL, Wold RC, Tefferi A (2003). "Rituximab for Immune Cytopenia in Adults: Idiopathic Thrombocytopenic Purpura, Autoimmune Hemolytic Anemia, and Evans Syndrome" (PDF). Mayo Clinic Proceedings. 78 (11): 1340–1346. doi:10.4065/78.11.1340. PMID 14601692. Archived from the original (PDF) on 2006-03-13.
- ↑ A. Razzaque Ahmed, M.D.; Zachary Spigelman, M.D.; Lisa A. Cavacini, Ph.D.; Marshall R. Posner, M.D. (26 October 2006). "Treatment of Pemphigus Vulgaris with Rituximab and Intravenous Immune Globulin". N Engl J Med. 355 (17): 1772–1779. doi:10.1056/nejmoa062930. PMID 17065638.
- ↑ Jacob A, Weinshenker BG, Violich I, McLinskey N, Krupp L, Fox RJ, Wingerchuk DM, Boggild M, Constantinescu CS, Miller A, De Angelis T, Matiello M, Cree BA (2008). "Treatment of neuromyelitis optica with rituximab: retrospective analysis of 25 patients". Arch Neurol. 65 (11): 1443–1448. doi:10.1001/archneur.65.11.noc80069. PMID 18779415.
- ↑ "Rituximab Treatment of Patients with Severe, Corticosteroid-Resistant Thyroid-Associated Ophthalmopathy". Archived from the original on 2017-08-22. Retrieved 2011-10-19.
- ↑ "Immunomodulators and Rituximab in the Management of Autoimmune Pancreatitis". doi:10.3998/panc.2013.20. Archived from the original on 2014-05-02. Retrieved 2014-04-30.
{{cite journal}}: Cite journal requires|journal=(help) - ↑ Pranzatelli, M. R. (2004). "Immunologic and Clinical Responses to Rituximab in a Child with Opsoclonus-Myoclonus Syndrome". Pediatrics. 115 (1): e115–9. doi:10.1542/peds.2004-0845. PMID 15601813.
- ↑ Khosroshahi, A.; Wallace, Z. S.; Crowe, J. L.; Akamizu, T.; Azumi, A.; Carruthers, M. N.; Chari, S. T.; Della-Torre, E.; Frulloni, L.; Goto, H.; Hart, P. A.; Kamisawa, T.; Kawa, S.; Kawano, M.; Kim, M. H.; Kodama, Y.; Kubota, K.; Lerch, M. M.; Löhr, M.; Masaki, Y.; Matsui, S.; Mimori, T.; Nakamura, S.; Nakazawa, T.; Ohara, H.; Okazaki, K.; Ryu, J.H.; Saeki, T.; Schleinitz, N.; et al. (2015). "International Consensus Guidance Statement on the Management and Treatment of IgG4-Related Disease". Arthritis & Rheumatology. 67 (7): 1688–1699. doi:10.1002/art.39132. PMID 25809420. S2CID 39750214.
- ↑ He Y, Shimoda M, Ono Y, Villalobos IB, Mitra A, Konia T, Grando SA, Zone JJ, Maverakis E (2015). "Persistence of Autoreactive IgA-Secreting B Cells Despite Multiple Immunosuppressive Medications Including Rituximab". JAMA Dermatol. 151 (6): 646–50. doi:10.1001/jamadermatol.2015.59. PMID 25901938.
- ↑ Molloy, Eamonn S.; Calabrese, Leonard H. (2012). "Progressive multifocal leukoencephalopathy associated with immunosuppressive therapy in rheumatic diseases: Evolving role of biologic therapies". Arthritis & Rheumatism. 64 (9): 3043–3051. doi:10.1002/art.34468. PMID 22422012.
- ↑ Burton C, Kaczmarski R, Jan-Mohamed R (2003). "Interstitial pneumonitis related to rituximab therapy". N Engl J Med. 348 (26): 2690–1, discussion 2690–1. doi:10.1056/NEJM200306263482619. PMID 12826649.
- ↑ "Reports of Bowel Obstruction and Perforation with RITUXAN (rituximab)" (PDF). Roche Canada. 2006-11-10. Archived from the original (PDF) on 2014-03-27.
- ↑ "Rituximab (marketed as Rituxan) Information". U.S. Food and Drug Administration (FDA). 2015-07-23. Archived from the original on 15 November 2009. Retrieved 15 November 2009.
- ↑ "Rituximab, RA and PML" (PDF). U.S. Food and Drug Administration (FDA). Archived from the original (PDF) on 2008-09-16. Retrieved 2008-09-14.
- ↑ Kriston, Levente (2009). "Challenges in Reporting Meta-analyses of Diagnostic Accuracy Studies". Annals of Internal Medicine. 150 (6): 430. doi:10.7326/0003-4819-150-6-200903170-00025. PMID 19293085.
- ↑ Seyfizadeh, Narges; Seyfizadeh, Nayer; Hasenkamp, J; Huerta-Yepez, S (2016). "A molecular perspective on rituximab: A monoclonal antibody for B cell non Hodgkin lymphoma and other affections". Crit Rev Oncol Hematol. 97: 275–290. doi:10.1016/j.critrevonc.2015.09.001. PMID 26443686.
- ↑ Rudnicka, D.; Oszmiana, A.; Finch, D. K.; Strickland, I.; Schofield, D. J.; Lowe, D. C.; Sleeman, M. A.; Davis, D. M. (2013). "Scientists discover why a specific cancer drug is so effective". Blood. 121 (23): 4694–4702. doi:10.1182/blood-2013-02-482570. PMID 23613524. Archived from the original on 2013-05-03. Retrieved 2013-04-29.
- ↑ Rudnicka, D.; Oszmiana, A.; Finch, D. K.; Strickland, I.; Schofield, D. J.; Lowe, D. C.; Sleeman, M. A.; Davis, D. M. (2013). "Rituximab causes a polarization of B cells that augments its therapeutic function in NK-cell-mediated antibody-dependent cellular cytotoxicity". Blood. 121 (23): 4694–4702. doi:10.1182/blood-2013-02-482570. PMID 23613524.
- ↑ Shaw, T. (2003). "B cell therapy for rheumatoid arthritis: The rituximab (anti-CD20) experience". Annals of the Rheumatic Diseases. 62 (90002): 55ii–59. doi:10.1136/ard.62.suppl_2.ii55. PMC 1766758. PMID 14532151.
- ↑ Binder M, Otto F, Mertelsmann R, Veelken H, Trepel M. (2006). "The epitope recognized by rituximab". Blood. 108 (6): 1975–1978. doi:10.1182/blood-2006-04-014639. PMID 16705086.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ DrugBank DB00073 بایگانیشده در ۲۰۱۴-۰۱-۰۵ توسط Wayback Machine
- ↑ Maloney DG, Grillo-López AJ, White CA, et al. (September 1997). "IDEC-C2B8 (Rituximab) anti-CD20 monoclonal antibody therapy in patients with relapsed low-grade non-Hodgkin's lymphoma". Blood. 90 (6): 2188–95. doi:10.1182/blood.V90.6.2188. PMID 9310469. Archived from the original on 20 March 2020. Retrieved 23 March 2021.
- ↑ Scott, Shane D. (1998). "Rituximab: A New Therapeutic Monoclonal Antibody for Non-Hodgkin's Lymphoma". Cancer Practice. 6 (3): 195–197. doi:10.1046/j.1523-5394.1998.006003195.x. PMID 9652253.
- ↑ Harrison's Principles of Internal Medicine, Longo et al. McGraw Hill Medical 2011 page 931
- ↑ "Roche Gets EC Nod for Follicular Lymphoma Maintenance Therapy". 29 October 2010. Archived from the original on 31 October 2010.
- ↑ "EU approves second indication for subcutaneous form of Roche's rituximab". Archived from the original on 2016-06-07. Retrieved 2016-06-09.
- ↑ ۵۰٫۰ ۵۰٫۱ "Biosimilars of Rituximab" (به انگلیسی). Generics and Biosimilars Initiative. 14 April 2017. Archived from the original on 2017-03-31. Retrieved 2017-04-29.
- ↑ "FDA approves first biosimilar for treatment of adult patients with non-Hodgkin's lymphoma". U.S. Food and Drug Administration (FDA) (Press release). 28 November 2018. Retrieved 11 November 2019.
- ↑ Lahiri, Diptendu; Osterman, Cynthia (2 November 2018). "Novartis abandons effort for U.S. approval of biosimilar rituximab". Reuters. Retrieved 3 November 2018.
- مشارکتکنندگان ویکیپدیا. «Rituximab». در دانشنامهٔ ویکیپدیای انگلیسی، بازبینیشده در ۲۸ اکتبر ۲۰۱۷.