ورود ویروس
 |
ورود ویروس، اولین مرحلهٔ آلودگی در چرخه زندگی ویروس، هنگامی است که ویروس با سلول میزبان در تماس است و مواد ویروسی را به داخل سلول وارد میکند. مراحل عمده ورود ویروس در زیر نشان داده شدهاست.[۱] با وجود تنوع در بین ویروسها، چند کلیت مشترک در مورد ورود آنها وجود دارد.
مجاورت با سلول
[ویرایش]ویروس شناور در فضای محصور با سلولهای میزبان احتمالی با یک مانع بزرگ به نام ترمودینامیک انتشار روبرو میشود. از آنجا که اشیاء با بار خنثی بهطور طبیعی دور هم جمع نمیشوند، ویروس باید راهی برای حرکت برای نزدیکی به سلول میزبان پیدا کند. این کار را با اتصال یا جذب - بر روی یک سلول انجام میدهد. سلول دارای گیرندهای که ویروس میتواند به آن وصل شود. گیرندههای روی پوشش ویروسی بهطور مؤثر به گیرندههای مکمل روی غشای سلول متصل میشوند. این پیوست باعث میشود که این دو غشا در مجاورت یکدیگر باقی بمانند و به تعامل بیشتر بین پروتئینهای سطحی کمک کند. این عمل همچنین نخستین لازمهای است که باید پیش از آلوده شدن سلول، اجرا شود. اجرای این لازمه سلول را مستعد و آسیبپذیر میکند. ویروسهایی که این رفتار را نشان میدهند شامل بسیاری از ویروسهای پوششدار مانند HIV و ویروس هرپس سیمپلکس هستند.
این نظر پایهای در مورد ویروسهای بدون پوشش نیز درست است. نمونههایی که به خوبی مورد مطالعه قرار گرفتهاند ویروسهایی هستند که باکتریها را آلوده میکنند و با نام باکتریوفاژها (یا صرفاً فاژ) شناخته میشوند. فاژهای معمولی دارای دمهای بلند برای اتصال به گیرندههای سطح باکتری هستند.
بررسی اجمالی
[ویرایش]پیش از ورود، ویروس باید به سلول میزبان متصل شود. اتصال هنگامی حاصل میشود که پروتئینهای ویژهای روی کپسید یا پوشش ویروس به پروتئینهای ویژهای بهنام پروتئینهای گیرنده روی غشای سلول هدف وصل شوند. اکنون ویروس باید وارد سلول شود که توسط دو لایهٔ فسفولیپیدی پوشانده شدهاست. روندی که توسط آن این سد شکسته میشود، بستگی به ویروس دارد. انواع ورود عبارتند از:
- آمیزش (فیوژن) غشایی یا حالت نیمهآمیختگی (همیفیوژن): غشای سلولی سوراخ میشود و به اتصال بیشتر با پوشش ویروسی در حال بازشدن واداشته میشود.
- درونبری (اندوسیتوز): سلول میزبان از طریق فرایند درونبری، ذرهٔ ویروس را میگیرد، در واقع ویروس را مانند یک ذرهٔ غذایی فرو میبرد.
- رخنهٔ ویروس: کپسید یا ژنوم ویروس به سیتوپلاسم سلول میزبان تزریق میشود.
با استفاده از پروتئین فلورسنت سبز (GFP)، ورود ویروس و عفونت بیدرنگ دیده میشود. هنگامی که ویروس وارد سلول میشود، تکثیر فوری انجام نمیشود و البته مدتی طول میکشد (چند ثانیه تا چند ساعت).[۲][۳]
ورود از طریق آمیزش غشایی
[ویرایش]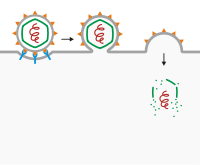
شناختهشدهترین روش ورود ویروس «آمیزش غشایی» است. در ویروسهای پوششدار، گیرندههای ویروس به گیرندههای روی سطح سلول وصل میشوند و گیرندههای ثانویه ممکن است برای شروع سوراخ کردن غشا یا آمیزش با سلول میزبان وجود داشته باشند. پس از اتصال، پوشش ویروس با غشای سلول میزبان آمیخته و ویروس بدون پوشش را درون سلول خالی میکند. در اصل، پوشش ویروس با غشای سلول میزبان «مخلوط» میشود و محتویات آن را درون سلول آزاد میکند. بدیهی است، این کار فقط با ویروسهایی که پوشش دارند میتواند انجام شود (HIV , KSHV[۴][۵][۶][۷] و ویروس هرپس سیمپلکس از جمله این ویروسها هستند).[۸]
ورود از طریق درونبری
[ویرایش]
ویروسهای بدون پوشش از طریق درونبری وارد سلول میشوند. آنها توسط سلول میزبان از طریق غشای سلولی بلعیده میشوند. در حقیقت، ویروس به سلول القا میکند که تنها غذا یا مادهای بیضرر است. سلول، که بهطور طبیعی با اتصال مواد به گیرندههای سطحی و وارد کردن آنها به سلول، منابع محیطی را از آن خود میکند، ویروس را نیز فرو میبرد. ویروس بعد از ورود به سلول، باید از وزیکولی که آن را به درون سلول آورده، خارج شود تا بتواند به سیتوپلاسم دسترسی پیدا کند. ویروس فلج اطفال، ویروس هپاتیت C[۹] و ویروس بیماری دست، پا و دهان از جمله ویروسهایی هستند که از این روش بهره میبرند.[۱۰]
بسیاری از ویروسهای پوششدار نیز از طریق درونبری وارد سلول میشوند. ورود از طریق آندوزوم، pH پایین و قرار گرفتن در معرض پروتئازهای مورد نیاز برای بازکردن کپسید ویروس و آزاد کردن مواد ژنتیکی موجود در آن را تضمین میکند. علاوه بر این، اندوزومها ویروس را در طول سلول منتقل میکنند و اطمینان حاصل میکنند که هیچ اثری از ویروس روی سطح باقی نماندهاست، که ممکن است باعث تشخیص ایمنی شود.[۱۱]
ورود از طریق تزریق ژن
[ویرایش]نمونهٔ سوم و ویژهتر از طریق اتصال به سطح سلول بهوسیلهٔ گیرندههای روی سلول و تزریق فقط ژنوم آن به داخل سلول و رها کردن باقیماندهٔ ویروس روی سطح سلول انجام میشود. این عمل محدود به ویروسهایی است که در آنها فقط ژن برای آلوده کردن سلول مورد نیاز است (بیشتر ویروسهای RNA جهت مثبت و تکرشته زیرا میتوانند بلافاصله ترجمه شوند). بهترین نمونه مطالعهشده باکتریوفاژها هستند. به عنوان مثال، وقتی الیاف دم فاژ T2 روی سلول قرار میگیرد، غلاف مرکزی آن غشای سلولی را سوراخ میکند و فاژ DNA را از کپسید بالایی مستقیماً به درون سلول تزریق میکند.[۱۲]
نتایج
[ویرایش]هنگامی که ویروس در سلول است، میتواند پروتئینها را فعال کند (به خودی خود یا با استفاده از میزبان) تا در صورت امکان بتواند کنترل کامل سلول میزبان را بهدست بگیرد. مکانیسمهای کنترل شامل سرکوب دفاع سلولهای درونی، سرکوب هشداردهی سلول و سرکوب رونویسی و ترجمه سلول میزبان است. غالباً این اثرات سمیت سلولی است که منجر به مرگ و زوال سلول آلوده به ویروس میشود.
اگر ویروس قادر به ورود به سلول باشد، سلول به عنوان مستعد ابتلا به ویروس طبقهبندی میشود. پس از معرفی ذرات ویروسی، بازگشایی محتویات (پروتئینهای ویروس در تگنمونت و ژنوم ویروس از طریق نوعی از اسید نوکلئیک) به عنوان آمادهسازی برای مرحلهٔ بعدی از عفونت ویروسی یعنی تکثیر ویروس رخ میدهد.
جستارهای وابسته
[ویرایش]منابع
[ویرایش]- ↑ Subramanian RP, Geraghty RJ (20 February 2007). "Herpes simplex virus type 1 mediates fusion through a hemifusion intermediate by sequential activity of glycoproteins D, H, L, and B". Proceedings of the National Academy of Sciences, USA. 104 (8): 2903–8. doi:10.1073/pnas.0608374104. PMC 1815279. PMID 17299053.
- ↑ Lakadamyali, Melike; Michael J. Rust; Hazen P. Babcock; Xiaowei Zhuang (2003). "Visualizing infection of individual influenza viruses". Proceedings of the National Academy of Sciences of the United States of America. 100 (16): 9280–9285. doi:10.1073/pnas.0832269100. PMC 170909. PMID 12883000.
- ↑ Joo, K-I; P Wang (2008-05-15). "Visualization of Targeted Transduction by Engineered Lentiviral Vectors". Gene Ther. 15 (20): 1384–1396. doi:10.1038/gt.2008.87. ISSN 0969-7128. PMC 2575058. PMID 18480844.
- ↑ Kumar, Binod; Chandran, Bala (November 14, 2016). "KSHV Entry and Trafficking in Target Cells-Hijacking of Cell Signal Pathways, Actin and Membrane Dynamics". Viruses. 8 (11): 305. doi:10.3390/v8110305. ISSN 1999-4915. PMC 5127019. PMID 27854239.
- ↑ Kumar, Binod; Dutta, Dipanjan; Iqbal, Jawed; Ansari, Mairaj Ahmed; Roy, Arunava; Chikoti, Leela; Pisano, Gina; Veettil, Mohanan Valiya; Chandran, Bala (October 2016). "ESCRT-I Protein Tsg101 Plays a Role in the Post-macropinocytic Trafficking and Infection of Endothelial Cells by Kaposi's Sarcoma-Associated Herpesvirus". PLoS Pathogens. 12 (10): e1005960. doi:10.1371/journal.ppat.1005960. ISSN 1553-7374. PMC 5072609. PMID 27764233.
- ↑ Veettil, Mohanan Valiya; Kumar, Binod; Ansari, Mairaj Ahmed; Dutta, Dipanjan; Iqbal, Jawed; Gjyshi, Olsi; Bottero, Virginie; Chandran, Bala (April 2016). "ESCRT-0 Component Hrs Promotes Macropinocytosis of Kaposi's Sarcoma-Associated Herpesvirus in Human Dermal Microvascular Endothelial Cells". Journal of Virology. 90 (8): 3860–3872. doi:10.1128/JVI.02704-15. ISSN 1098-5514. PMC 4810545. PMID 26819309.
- ↑ Khanna, Madhu; Sharma, Sachin; Kumar, Binod; Rajput, Roopali (2014). "Protective Immunity Based on the Conserved Hemagglutinin Stalk Domain and Its Prospects for Universal Influenza Vaccine Development". BioMed Research International (به انگلیسی). 2014: 546274. doi:10.1155/2014/546274. ISSN 2314-6133. PMC 4055638. PMID 24982895.
- ↑ Campadelli-Fiume G, Amasio M, Avitabile E, Cerretani A, Forghieri C, Gianni T, Menotti L. "The multipartite system that mediates entry of herpes simplex virus into the cell." Rev Med Virol. 2007 Sep-Oct;17(5):313-26. Review.
- ↑ Helle F, Dubuisson J. "Hepatitis C virus entry into host cells." Cell Mol Life Sci. 2007 Oct 4
- ↑ N.J. Dimmock et al. "Introduction to Modern Virology, 6th edition." Blackwell Publishing, 2007.
- ↑ Howley, Peter M; Knipe, David M "Fields Virology" Lippincott Williams & Williams 2013
- ↑ Sebestyén MG, Budker VG, Budker T, Subbotin VM, Zhang G, Monahan SD, Lewis DL, Wong SC, Hagstrom JE, Wolff JA. "Mechanism of plasmid delivery by hydrodynamic tail vein injection. I. Hepatocyte uptake of various molecules." J Gene Med. 2006 Jul;8(7):852-73.
