پاراکوکسیدیویدس براسیلینسیس
این مقاله نیازمند ویکیسازی است. لطفاً با توجه به راهنمای ویرایش و شیوهنامه، محتوای آن را بهبود بخشید. |
این مقاله دقیق، کامل و صحیح ترجمه نشده و نیازمند ترجمه به فارسی است. کل یا بخشی از این مقاله به زبانی بهجز زبان فارسی نوشته شدهاست. اگر مقصود ارائهٔ مقاله برای مخاطبان آن زبان است، باید در نسخهای از ویکیپدیا به همان زبان نوشته شود (فهرست ویکیپدیاها را ببینید). در غیر این صورت، خواهشمند است ترجمهٔ این مقاله را با توجه به متن اصلی و با رعایت سیاست ویرایش، دستور خط فارسی و برابر سازی به زبان فارسی بهبود دهید و سپس این الگو را از بالای صفحه بردارید. همچنین برای بحثهای مرتبط، مدخل این مقاله در فهرست صفحههای نیازمند ترجمه به فارسی را ببینید. اگر این مقاله به زبان فارسی بازنویسی نشود، تا دو هفتهٔ دیگر نامزد حذف میشود و/یا به نسخهٔ زبانی مرتبط ویکیپدیا منتقل خواهد شد. اگر شما اخیراً این مقاله را بهعنوان صفحهٔ نیازمند ترجمه برچسب زدهاید، لطفاً عبارت {{جا:هبک-ترجمه به فارسی|1=پاراکوکسیدیویدس براسیلینسیس}} ~~~~را نیز در صفحهٔ بحث نگارنده قرار دهید. |
| پاراکوکسیدیویدس براسیلینسیس | |
|---|---|
| |
| ردهبندی علمی | |
| فرمانرو: | قارچ |
| دسته: | قارچهای کیسهای |
| رده: | یوروتیومیستس |
| راسته: | Onygenales |
| تیره: | Ajellomycetaceae |
| سرده: | Paracoccidioides brasiliensis |
| گونه: | P. brasiliensis |
| نام دوبخشی | |
| Paracoccidioides brasiliensis (Splend.) F.P.Almeida (1930)
| |
| مترادف | |
|
Zymonema brasiliensis Splend. (1912) | |
پاراکوکسیدیویدس براسیلینسیس (نام علمی: Paracoccidioides brasiliensis) یک قارچ دیمورفیک و عامل ایجادکننده بیماری paracoccidioidomycosis است.[۱][۲][۳] این قارچ به خانواده Ajellomycetaceae (بخش Ascomycota) وابسته است، گرچه وضعیت تلومورف هنوز مشخص نشدهاست.[۴]
تاریخچه
[ویرایش]Paracoccidioides brasiliensis ابتدا توسط Adolfo Lutz در سال ۱۹۰۸ در برزیل کشف شد.[۵] گرچه Lutz نامی برای بیماری ناشی از این قارچ را پیشنهاد نکرد، وی ساختارهایی را که به نام "pseudococcidica" همراه با میسلیوم رشد کرده در کشت در ۲۵ ° C در سال ۱۹۱۲، نام Zymonema brasiliense[۶] پیشنهاد کرد و ویژگیهای قارچ را شرح داد.[۵] در نهایت در سال ۱۹۳۰، فلورینو د المیردا جنس Paracoccidioides را برای تطابق با گونه ایجاد کرد، و تمایز آن با Coccidioides immitis را ذکر کرد.[۵]
فیزیولوژی
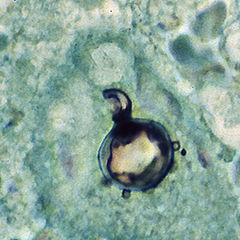
[ویرایش]Paracoccidioides brasiliensis یک یوکاریوت بدون حالت سنتتیکی نوری با دیواره سلولی سفت و محکم است که بسیار شبیه به یوکاریوتهای پیشرفته تر است.[۲][۷] به عنوان یک قارچ دیمورفیک، قادر به رشد به شکل مخمر بیضوی در ۳۷ ° C و یک فرم میلوئالی بلند که در دمای اتاق تولید میشود.[۸] فازهای Mycelial و مخمر در مورفولوژی، بیوشیمی و فراصوت آنها متفاوت است.[۷] فرم مخمر شامل مقدار زیادی از گلوکان α- (۱،3) -linkedاست.[۹][۱۰] محتوای کیتین فرم قارچ بیشتر از فرم مخمر است، اما محتوای چربی در هر دو فاز یکسان است.[۹] مخمر توسط جوانه زنی غیرمعمول تولید میشود، که در آن سلولهای دختر بهطور غیرمستقیم در چندین موقعیت تصادفی در سطح سلول قرار میگیرند. جوانهها در لایههای دیواره سلولی تولید میشوند.[۲] هنگامی که جوانه به وجود آمدهاست، یک شکاف بین سلولهای سرطانی و سلول مادر ایجاد میشود. پس از انهدام، زخم جوانه ناپدید میشود.[۷] در بافت، جوانه زدن در مرکز گرانولوماتوز ضایعه بیماری ایجاد میکند، همانطور که با رنگ آمیزی بخشهای بافتشناسی هماتوکسیلین و ائوزین (H & E) مشخص میشود.[۹] سلولهای Nonbuddingدارای ۵ تا ۱۵ μm قطر هستند، در حالی که سلولهای جوانههای کروی چندگانه را از ۱۰–۲۰ میکرو متر اندازهگیری میکنند[۹] در میکروسکوپ الکترونی، سلولهایی با جوانههای متعدد یافت میشود که هسته و سیتوپلاسم در محیط اطراف محصور شدهاند.[۱۱] در فرم بافت P. brasiliensis، سلولهای مخمر با دیوارههای نازکتر و پایههای باریکتر از آنهایی که از قارچهای دیمورفیک آن، Blastomycosis dermatitidis، موجود است دیده میشود.[۹] شکل مخمر مانند P. brasiliensis شامل هستههای چندگانه، غشاء هسته دو لایه متخلخل و یک دیواره سلولی ضخیم غنی از الیاف است، در حالی که فاز میسیلی دیواره سلولی نازک با لایه بیرونی الکترونی دارد.[۷]۳
دیمورفیسم
[ویرایش]شکل میسیلی P. brasiliensis را میتوان در شرایط in vitro با تزریق آگار قلبی مغزی یا آگار گلوکز خون سیستئین و با انکوبه کردن به مدت ۱۰–۲۰ روز در ۳۷ ° C[۹] در این شرایط، سلولهای هیفا یا میمیرند یا تبدیل به فرمهای انتقالی به اندازه ۶–۳۰ μm د، که در نهایت بر روی سلولهای هیپال جدا شده یا باقی میماند و جوانه میزند.[۹] جوانهها مزوزوم را توسعه میدهند و به چند هسته ای تبدیل میشوند.[۹] در مقابل، کشتهای مخمر مانند میتواند با کاهش دمای انکوباسیون از ۳۷ تا ۲۵ به شکل میسیلی تبدیل شود[۱۲] در ابتدا، الزامات تغذیه هر دو مرحله مخمر و میسالی P. brasiliensis، یکسان بود؛[۱۳] با این حال، بعد از مطالعات نشان داده فرم مخمر به auxotrophic، نیازمند اسیدهای آمینه حاوی گوگرد اگزوژن از جمله سیستئین و متیونین برای رشد است.[۱۴]
محیط زیست
[ویرایش]گرچه زیستگاه P. brasiliensis هنوز ناشناخته باقی ماندهاست، معمولاً با خاکهایی که قهوه کشت میشود، مرتبط است.[۴][۱۵][۱۶] این نیز با فرسایشی 9-banded , Dasypus novemcinctus همراه است.[۱۷] بیماری ناشی از P. brasiliensis عمدتاً از لحاظ جغرافیایی محدود به کشورهای آمریکای لاتین مانند برزیل، کلمبیا و ونزوئلا است و بیشترین تعداد موارد در برزیل دیده میشود.[۹] مناطق اندمیک با تابستانهای گرم و مرطوب، زمستانهای معتدل خشک، دمای متوسط سالانه بین ۱۷ تا ۲۳ درجه سانتیگراد مشخص میشود، که بارندگی سالانه بین ۵۰۰ و ۸۰۰ میلیمتر[۱۸] دارند. با این حال، قوانین زیستمحیطی سخت گیر وجود دارد و P. brasiliensis به ندرت در طبیعت خارج از میزبان انسان مواجه میشود.[۲] یکی از نمونههای بسیار نادر انزوای زیستمحیطی در سال ۱۹۷۱ توسط ماریا باند البرنوز و همکارانش که P. brasiliensis از نمونههایی از خاک روستایی که در Paracotos در ایالت میراندا ونزوئلا جمعآوری شده بود، گزارش شدهاست.[۱۹] همچنین نشان داده شدهاست که فاز میسلیالی طول عمر بیشتری نسبت به فاز مخمر در خاک اسیدی دارد.[۲۰]
همه گیرشناسی
[ویرایش]P. brasiliensis باعث بیماری شناخته شده به عنوان paracoccidioidomycosis مشخص شده با تغییرات granulomatous آهسته و پیشرفته در مخاط، به ویژه بینی و سینوسها یا پوست است. به ندرت، بیماری بر سیستم لنفاوی، سیستم عصبی مرکزی، دستگاه گوارش یا سیستم اسکلتی تأثیر میگذارد.[۹] با توجه به میزان بالایی از مواردی که بر مخاط دهان تأثیر میگذارد، این بافتها در ابتدا تصور میشد که مسیر اصلی ورود به قارچ است.[۲] با این حال، شواهد قوی در حال حاضر نشان میدهد که دستگاه تنفسی مکان اصلی ورود است[۹] و ضایعات برازیلینسیس ریه که رخ میدهد در نزدیک به یک سوم از موارد مترقی است.[۲۱] این بیماری مسری نیست[۹] Paracoccidioidomycosis در مردان بالغ بیشتر از زنان دیده میشود.[۹][۲۲] به نظر میرسد که استروژن هورمون مانع از تغییر شکل میسیالال به شکل مخمر میشود، که با دادههای آزمایشی in vitro پشتیبانی میشود و این عامل میتواند مقاومت نسبی زنان را به عفونت تبدیل کند.[۲۳]
تشخیص و پیشگیری
[ویرایش]تعدادی از آزمایشهای سرولوژیکی برای تشخیص پاراوکسیدیوئیدومیکوز استفاده شدهاست.[۹] انتشار دوطرفه در ژل آگار و تثبیت مکمل، در میان تستهای رایج مورد استفاده در تشخیص سرود قرار دارند.[۹] عصارههای مخمر یا میسلیا برای تولید آنتیژنهای مؤثر، سریع و قابل تجدید بهرهبرداری میشوند.[۹][۲۴] در یک مطالعه، تشخیص آنتیژن ۴۳ کیلودالتون در سرمهای مشترک افراد مبتلا به بیماری که ممکن است مبنایی برای توسعه یک آزمایش تشخیصی باشد، گزارش شدهاست.[۲۵][۹]
تظاهرات بالینی
[ویرایش]P. brasiliensis باعث زخمی شدن غشای مخاطی دهان و بینی میشود و از طریق سیستم لنفاوی گسترش مییابد. یک فرضیه برای ورود قارچ به بدن از طریق غشای پریودنتال است.[۲۶][۲۷] مسیر عفونت در معرض استنشاق قرار گرفتهاست که به دنبال آن میتواند منجر به ایجاد واکنشهای عفونی به شکلهای مخلوط چندپاشی مجدد در ریه مانند شبیه " چرخ کشتی " در بخشهای بافتشناسی شود.[۸][۲۸] هر دو افراد ایمنولوژیک طبیعی و مصدوم در معرض خطر ابتلا به عفونت هستند.[۸] ریهها، گرههای لنفاوی و غشای مخاطی دهان بیشتر بافتهای آلوده هستند.[۹] ویژگیهای پاتولوژیک paracoccidioidomycosis شبیه به کسانی که دیده میشود در می کوکسیدیوئیدومایکوزیس و بالستومایکوز.[۲۹] با این حال، در ابتدا، ضایعات ابتدا در بافت لنفوئیدی ظاهر میشوند و سپس به غشاهای مخاطی گسترش مییابند،[۲۹] تولید نکروز بافتی منتشر شده در ناحیه غدد لنفاوی.[۲۹] دخالت معمولاً گستردهای از بافت لنفاوی و وقوع محدود از دستگاه گوارش، استخوان و پروستات جدا از آن از مجموعه ای از تصویر بالینی paracoccidioidomycosis بالستومایکوز.[۹][۲۹]
منابع
[ویرایش]- ↑ رایان KJ (2004). میکروبیولوژی پزشکی شریس (ویرایش چهارم). McGraw Hill. پ. 683. ISBN 0-8385-8529-9.
- ↑ ۲٫۰ ۲٫۱ ۲٫۲ ۲٫۳ ۲٫۴ سازمان بهداشت جهانی Pan. انتشارات علمی شماره 254 (1971). Paracoccidioidomycosis (ویرایش اول). واشینگتن پان آمریکایی سازمان بهداشت جهانی. پ. 325
- ↑ Brummer E، Castaneda E، Restrepo A (1993). "Paracoccidioidomycosis: به روز رسانی". کلین میکروبیولو Rev. 6 (2): 89-117. doi: 10.1128 / cmr.6.2.89. PMC 358272. PMID 8472249.
- ↑ ۴٫۰ ۴٫۱ Bagagli E، Theodoro RC, Bosco SM، و همکاران. (2008). " Paracoccidioides brasiliensis: جنبههای فیلوژنتیک و زیست محیطی". مایکوپاتولوژی 165 (4-5): 197-207. doi: 10.1007 / s11046-007-9050-7. PMID 18777629.
- ↑ ۵٫۰ ۵٫۱ ۵٫۲ Lacaz, CS؛ فرانکو (1994). "تکامل تاریخی دانش در paracoccidioidomycosis و عامل اتیولوژیک آن، Paracoccidioides brasiliensis". بوکا راتون: CRC مطبوعات: 1-11.
- ↑ http://www.whonamedit.com/doctor.cfm/1534.html
- ↑ ۷٫۰ ۷٫۱ ۷٫۲ ۷٫۳ کربنل، لوئیس م (1963). "زیر ساختار Paracoccidiodes brasiliensis". Mycopathologia et Mycologia Applicata. 19 (3): 184-204. doi: 10.1007 / bf02051247. ISSN 0027-5530. PMID 14045074.
- ↑ ۸٫۰ ۸٫۱ ۸٫۲ ریس، E (2011). سرطان پستان پزشکی. نیوجرسی: ویلی بلکول: هوبکن. پ. 624. ISBN 9780470177914.
- ↑ ۹٫۰۰ ۹٫۰۱ ۹٫۰۲ ۹٫۰۳ ۹٫۰۴ ۹٫۰۵ ۹٫۰۶ ۹٫۰۷ ۹٫۰۸ ۹٫۰۹ ۹٫۱۰ ۹٫۱۱ ۹٫۱۲ ۹٫۱۳ ۹٫۱۴ ۹٫۱۵ ۹٫۱۶ ۹٫۱۷ ۹٫۱۸ کوون چانگ، KJ؛ بنت جان E (1992). سرطان پزشکی. فیلادلفیا: فیلادلفیا: لی و فایگر. ISBN 0812114639.
- ↑ کانتسونا، F؛ و همکاران (1969). "ترکیب سلولی دیواره مخمر و میسالی شکل Paracoccidioides brasiliensis ". J. Bacteriol. 97 (3): 1036-1041. PMC 249811. PMID 5776517.
- ↑ Furtado, JS; Freymuller E. (1967). "ساختار و تولید مثل Paracoccidioides brasiliensis در بافت انسانی". Sabouraudia 5 (3): 226-229. doi: 10.1080 / 00362176785190431. PMID 6036228.
- ↑ رامیرز مارتینز، JR (1971). " Paracoccidioides brasiliensis : تبدیل فرمهای مخمر مانند به Mycelia در فرهنگ غرق". J. Bacteriol. 105 (2): 523-526. PMC 248414. PMID 5541529.
- ↑ جیلاردی، GL (1965). "تغذیه قارچهای بیماریزائی سیستماتیک و زیر پوستی". باکتریول Rev. 29 (3): 406-424. PMC 441289. PMID 5318450.
- ↑ پاریس، S; Duran-Gonzalez S. (1985). "مطالعات تغذیه ای در Paracoccidioides brasiliensis: نقش گوگرد آلی در دیمورفیسم". Sabouraudia 23 (2): 85-92. doi: 10.1080 / 00362178585380151. PMID 4012515.
- ↑ Flannigan، برین (2001). میکروارگانیسمها در محیطهای خانه و محیط داخلی: تنوع، تأثیرات بهداشتی، تحقیق و کنترل. نیویورک: تیلور و فرانسیس. پ. 479. ISBN 9780203302934.
- ↑ Terçarioli GR, Bagagli E، Reis GC، و همکاران. (2007). "بررسی محیط زیست Paracoccidioides brasiliensis در خاک: توانایی رشد، تولید کونیدیایی و تشخیص مولکولی". BMC Microbiol. 7: 92-99. doi: 10.1186 / 1471-2180-7-92.
- ↑ Bagagli, Eduardo; Bosco, Sandra M.G.; Theodoro, Raquel Cordeiro; Franco, Marcello (September 2006). "Phylogenetic and evolutionary aspects of Paracoccidioides brasiliensis reveal a long coexistence with animal hosts that explain several biological features of the pathogen". Infection, Genetics and Evolution. 6 (5): 344–351. doi:10.1016/j.meegid.2005.12.002.
- ↑ Borelli, D (1969). "Reservareas de algunos agents de micosis". مد برتان ایبر لات ام 3: 367-370.
- ↑ Albornoz, M؛ Albornoz (1971). "ویکیپدیا" ویکیپدیای انگلیسی، دانشنامه آزاد. مایکوپاتولوژی 45 (2): 65-75. doi: 10.1007 / bf02059246.
- ↑ Restrepo, M؛ و همکاران (1969). "اثر غلظت یون هیدروژن و دما بر رشد Paracoccidioides brasiliensis در عصاره خاک". Sabouraudia 7 (3): 207-215. doi: 10.1080 / 00362177085190371. PMID 5385156.
- ↑ Londero, AT; CD راموس (1972). "Paracoccidioidomycosis: یک مطالعه بالینی و میکروبی در 40 مورد در سانتا ماریا، RS، برزیل" مشاهده شد. صبح. J. Med. 52 (6): 771-775. doi: 10.1016 / 0002-9343 (72) 90083-6. PMID 5030174.
- ↑ Restrepo, M؛ Restrepo A (1970). "Paracoccidiomycosis (بلستومیکوز آمریکای جنوبی): مطالعه 39 مورد در مدلیین، کلمبیا". صبح. J. Trop. مد هیگ 19 (1): 68-76. PMID 4984585.
- ↑ Restrepo, M؛ و همکاران (1984). "استروژنها مانع از تبدیل منیزیم به مخمر در قارچ Paracoccidioides brasiliensis : پیامدهای مقاومت زنان به پاراکوکودیوئیدومایکوز" است. آلوده ایمون 46 (2): 346-353. PMC 261537. PMID 6500694.
- ↑ Blumer, SO؛ جالبرت م (1984). "روش سریع و قابل اعتماد برای تولید یک آنتی ژن تست ایمونوادسیاسینی خاص Paracoccidioides brasiliensis ". جین کلین. میکروبیولو 19 (3): 404-407. PMC 271074. PMID 6425358.
- ↑ مندس گینینی، MJS؛ و همکاران (1989). "تشخیص گلیکوپروتئین با وزن مولکولی 43000 در سرم بیماران مبتلا به پاراکوکودیومیکوز". جین کلین. میکروبیولو 27 (12): 2842-2845. PMC 267138 PMID 2592544.
- ↑ اسمیت جیم (1969). "Mycoses از دستگاه صفراوی". کیوی 10 (12): 1035-1040. doi: 10.1136 / gut.10.12.1035. PMC 1553013. PMID 4904223.
- ↑ گارسیا AM، هرناندز O, Aristizabal BH، و غیره. (2010). "تجزیه بیان ژن Paracoccidioides brasiliensis انتقال از conidium به سلول مخمر". مد مایکول 48 (1): 147-154. doi: 10.3109 / 13693780903055673. PMID 19568977.
- ↑ Restrepo A، McEwen JG, Castañeda E (2001). "زیستگاه Paracoccidioides brasiliensis: تا چه حد از حل معما؟". مد مایکول 39 (3): 233-41. دوی: 10.1080 / 714031028. PMID 11446526.
- ↑ ۲۹٫۰ ۲۹٫۱ ۲۹٫۲ ۲۹٫۳ رپیون، جان (1982). پزشکی پزشکی: قارچهای بیماریزا و اکتینومایکتهای بیماریزا (ویرایش دوم). فیلادلفیا: سوندرز. ISBN 0721675867.
پیوند به بیرون
[ویرایش]- Paracoccidioides در سرعنوانهای موضوعی پزشکی (MeSH) در کتابخانهٔ ملی پزشکی ایالات متحدهٔ آمریکا
- http://botit.botany.wisc.edu/toms_fungi/jan2005.html