Beetalaktaamit
| Tätä artikkelia tai sen osaa on pyydetty parannettavaksi, koska se ei täytä Wikipedian laatuvaatimuksia. Voit auttaa Wikipediaa parantamalla artikkelia tai merkitsemällä ongelmat tarkemmin. Lisää tietoa saattaa olla keskustelusivulla. Tarkennus: Kieli ja sisältö |
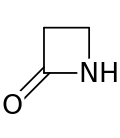
Beetalaktaamit ( β-laktaamit ) ovat orgaanisessa kemiassa yhdisteitä, jotka sisältävät rengasmaisen β-laktaamirakenteen. Tämän renkaan muodostavat vähintään kolme hiiliatomia, joista yhteen on kiinnittynyt happiatomi, sekä yksi typpiatomi. Happiatomi ja se hiiliatomi, johon se on kiinnittynyt, muodostavat yhdessä karbonyyliryhmän. Beetalaktaameissa typpiatomi on lisäksi kiinnittynyt β-hiiliatomiin suhteessa karbonyyliin, mihin nimityskin viittaa. Muiden laktaamien tavoin beetalaktaamit ovat syklisiä amideja.[1] Yksinkertaisin mahdollinen β-laktaami on 2-atsetidinoni. Monet antibiootit kuten penisilliinit kuuluvat beetalaktaameihin.
Lääketieteellinen merkitys
[muokkaa | muokkaa wikitekstiä]- Pääartikkeli: Beetalaktaamiantibiootit
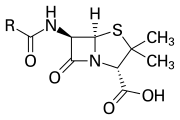
B-laktaamirengas on osa useiden antibioottiperheiden ydinrakennetta. Yleisimpiä niistä ovat penisilliinit, kefalosporiinit, karbapeneemit ja monobaktaamit, joita siksi kutsutaankin myös β-laktaamiantibiootteiksi. Lähes kaikki niistä vaikuttavat estämällä bakteerin soluseinämän biosynteesin. Tällä on tappava vaikutus bakteereihin, vaikka lähes jokainen bakteeripopulaatio sisältää myös alaryhmän, joka on resistentti β-laktaamiantibiooteille. Bakteerien vastustuskykyyn vaikuttavat monet geenit, joiden ansiosta ne tuottavat P-laktamaaseja eli entsyymejä, jotka rikkovat β-laktaamirenkaan. Erilaisilla bakteereilla on todettu olevan yli 1 800 erilaista β-laktamaasientsyymiä.[2] Nämä entsyymit eroavat toisistaan suuresti kemialliselta rakenteeltaan ja katalyyttiseltä tehokkuudeltaan.[3] Kun bakteeripopulaatioilla on näitä resistenttejä alaryhmiä, p-laktaamikäsittely voi johtaa siihen, että resistentistä kannasta tulee yleisempi ja siten virulenssisempi. β-laktaamipohjaisia antibiootteja voidaan pitää yhtenä tärkeimmistä antibioottiluokista, mutta niillä on taipumus kliiniseen resistenssiin. β-laktaamien antibioottiset ominaisuudet johtuvat siitä, että ne muistuttavat luonnossakin esiintyvää d-Ala-d-Ala-substraattientsyymejä, joita kutsutaan penisilliiniä sitoviksi proteiineiksi (PBP) ja joiden tehtävänä on silloittaa bakteerit peptidoglykaaniosa soluseinämässä. [4]
Historia
[muokkaa | muokkaa wikitekstiä]Ensimmäisen synteettisen beetalaktaamin valmisti Hermann Staudinger vuonna 1907 saattamalla aniliinin Schiff-emäksen ja bentsaldehydin reagoimaan difenyyliketeenin kanssa [5] kanssa [2 + 2]--sykloadditiossa. Seuraavassa kaaviossa Ph tarkoittaa funktionaalista fenyyliryhmää:
Vuoteen 1970 asti suurin osa β-laktaamitutkimuksista koski penisilliini- ja kefalosporiiniryhmiä, mutta siitä lähtien on löydetty laaja valikoima rakenteita. [6]
Synteesi
[muokkaa | muokkaa wikitekstiä]- Haudukaspotin synteesi: Substituoitujen beetalaktaamien synteesi beetaaminohappoestereiden syklisoinnissa käyttämällä Grignard-reagenssia . [7]
- De Bruinin ryhmä kertoi tehokkaasta katalyyttisestä synteettisestä strategiasta beeta-laktaamien suhteen, mukaan lukien keteenien synnyttäminen in situ ja myöhempi ansastus imiinien kanssa.[8] Välituotteena saadun karbeeniradikaalin karbonylointi, jossa välittäjäaineena käytetään halpaa ja erittäin aktiiviista koboltti(II)tetrametyylitetraaza[14]-annuuleenia [Co (MeTAA)], tarjoaa kätevän yhden astian menetelmän, jossa reaktioiden sarjan lopputuloksena saadaan trans-selektiivisiä beetalaktaameja.[9]
Reaktiokyky
[muokkaa | muokkaa wikitekstiä]Rengasjännityksen vuoksi β-laktaamit ovat helpommin hydrolysoitavia kuin lineaariset amidit tai suuremmat laktaamit. Tätä kantaa kasvatetaan edelleen yhdistämällä se toiseen renkaaseen, kuten useimmissa beetalaktaamiantibiooteissa. Tämä käytäntö johtuu siitä, että beetalaktaamin amidiominaisuus vähenee järjestelmän aplanariteetin vaikutuksesta. Typpiatomin ihanteellinen amidi, joka on sp 2-hybridisoitunut resonanssin vuoksi, ja sp 2-hybridisoituneista atomeilla on trigoniaalinen tasoimainen molekyyligeometria. Koska pyramidimaisen sidoksen geometria pakottaa typpiatomiin renkaan kantaan, resonanssi amidisidoksessa pienenee ja karbonyylista tulee ketonin kaltainen. Nobel-palkinnon saaja Robert Burns Woodward kuvasi parametrin h mitattuna typen ( huipun ) ja sen kolmen vierekkäisen atomin määrittelemän trigonaalipyramidin korkeudelle. h vastaa p-laktaamisidoksen lujuutta, jolla on pienemmät luvut (tasomaisempia; enemmän kuin ihanteelliset amidit), koska ne ovat vahvempia ja vähemmän reaktiivisia. [10] Monobaktaamien h- arvot ovat välillä 0,05–0,10 angströmiä (Å). Kefeemien h- arvot ovat välillä 0,20–0,25 Ä. Penamien arvot ovat välillä 0,40–0,50 Å, kun taas karbapeneemien ja clavamien arvot ovat 0,50–0,60 Å, koska ne ovat reaktiivisimpia β-laktaamien vaikutuksesta hydrolyysiin. [11]
Muut sovellukset
[muokkaa | muokkaa wikitekstiä]Uusi tutkimus on ehdottanut, että β-laktaamit voivat läpikäydä renkaan avautumisen, jolloin polymeroinnin amididokset muodostuvat nailon-3 polymeereistä. Näiden polymeerien runko on identtinen peptidien kanssa, jotka tarjoavat niille biofunktionaalisuuden. Nämä nylon-3-polymeerit voivat joko jäljitellä isännän puolustuspeptidejä tai toimia signaaleina 3T3- kantasolujen toiminnan stimuloimiseksi. [11]
Lisäproliferatiivisia aineita, jotka kohdistuvat tubuliiniin rakenteisiin β-laktaamien kanssa. [12] [13]
Katso myös
[muokkaa | muokkaa wikitekstiä]Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ Pentti Mälkönen: ”Aminohapot: Laktaamit”, Orgaaninen kemia, s. 202–203. Otava, 1979. ISBN 951-1-05378-7
- ↑ Christian Brandt, Sascha D. Braun, Claudia Stein, Peter Slickers, Ralf Ehricht, Mathias W. Pletz, Oliwia Makarewicz: In silico serine β-lactamases analysis reveals a huge potential resistome in environmental and pathogenic species. Scientific Reports, 24.2.2017. PubMed:28233789 doi:10.1038/srep43232 Bibcode:2017NatSR...743232B
- ↑ David E. Ehmann, Haris Jahić, Philip L. Ross, Rong-Fang Gu, Jun Hu, Gunther Kern, Grant K. Walkup, Stewart L. Fisher: Avibactam is a covalent, reversible, non–β-lactam β-lactamase inhibitor. Proceedings of the National Academy of Sciences of the United States of America (PNAS), 2012, 109. vsk, nro 29, s. 11663–11668. PubMed:22753474 doi:10.1073/pnas.1205073109 Bibcode:2012PNAS..10911663E
- ↑ D. J. Tipper, J. L. Strominger: Mechanism of action of penicillins: a proposal based on their structural similarity to acyl-D-alanyl-D-alanine. PNAS, 1965, 54. vsk, nro 4, s. 1133–1141. PubMed:5219821 doi:10.1073/pnas.54.4.1133 Bibcode:1965PNAS...54.1133T
- ↑ Thomas T. Tidwell: Hugo (Ugo) Schiff, Schiff Bases, and a Century of β‐Lactam Synthesis. Angewandte Chemie, 25.1.2018, 47. vsk, nro 6, s. 1016–1020. PubMed:18022986 doi:10.1002/anie.200702965
- ↑ Seyedmorteza Hosseyni, Aliasghar Jarrahpour: Recent advances in β-lactam synthesis. Organic & Biomolecular Chemistry, 2018, 16. vsk, nro 38, s. 6840–6852. PubMed:30209477 doi:10.1039/c8ob01833b
- ↑ Breckpot Synthesis Institute of Chemistry Skopje. Arkistoitu 6.11.2015.
- ↑ Nanda D. Paul, Andrei Chirila, Hongjian Lu, Peter Zhang, Bas de Bruin: Carbene Radicals in Cobalt(II)–Porphyrin‐Catalysed Carbene Carbonylation Reactions; A Catalytic Approach to Ketenes. Chemistry – a European Journal, 23.9.2013, 19. vsk, nro 38, s. 12953–12958. PubMed:24038393 doi:10.1002/chem.201301731
- ↑ Andrei Chirila, Kaj M. van Vliet, Nanda D. Paul, Bas de Bruin: [Co(MeTAA)] Metalloradical Catalytic Route to Ketenes via Carbonylation of Carbene Radicals. European Journal of Inorganic Chemistry, 2018, nro 20–21. doi:10.1002/ejic.201800101 ISSN 1099-0682 Artikkelin verkkoversio.
- ↑ Robert Burns Woodward: Penems and related substances. Philosophical Transactions of the Royal Society, 10.5.1980. PubMed:6109320 doi:10.1098/rstb.1980.0042 Bibcode:1980RSPTB.289..239W
- ↑ a b Ashwini Nangia, Kumar Biradha, Gautam R. Desiraju: Correlation of biological activity in β-lactam antibiotics with Woodward and Cohen structural parameters—a Cambridge database study. Journal of the Chemical Society, Perkin Transactions 2, 1996, nro 5. doi:10.1039/p29960000943
- ↑ Niamh M. O. Boyle, Miriam Carr, Lisa M. Greene, Orla Bergin, Seema M. Mathwan, Thomas McCabe, David G. Lloyd, Daniela M. Zisterer, Mary J. Meegan: Synthesis and Evaluation of Azetidinone Analogues of Combretastatin A-4 as Tubulin Targeting Agents. Journal of Medicinal Chemistry, 16.11.2010. PubMed:21080725 doi:10.1021/jm101115u Artikkelin verkkoversio.
- ↑ Niamh M. O. Boyle, Lisa M. Greene, Orla Bergin, Jean-Baptiste Fichet, Thomas McCabe, David G. Lloyd, Daniela M. Zisterer, Mary J. Meegan: Synthesis, evaluation and structural studies of antiproliferative tubulin-targeting azetidin-2-ones. Bioorganic & Medicinal Chemistry, 1.4.2011, 19. vsk, nro 7, s. 2306–2325. PubMed:21397510 doi:10.1016/j.bmc.2011.02.022 Artikkelin verkkoversio.



