Natriumamidi
| Natriumamidi | |
|---|---|
 |
|
| Tunnisteet | |
| CAS-numero | |
| PubChem CID | |
| Ominaisuudet | |
| Molekyylikaava | NaNH2 |
| Moolimassa | 39,016 g/mol |
| Ulkomuoto | Värittömiä kiteitä |
| Sulamispiste | 210 °C |
| Kiehumispiste | 400 °C |
| Tiheys | 1,37 g/cm3 |
| Liukoisuus veteen | Reagoi veden kanssa |
Natriumamidi (NaNH2) on ioniyhdiste. Aine reagoi hyvin herkästi veden kanssa ja on hyvin vahvasti emäksinen. Ainetta käytetään muun muassa orgaanisen kemian synteesireaktioissa.
Valmistus
[muokkaa | muokkaa wikitekstiä]Natriumamidia voidaan valmistaa natriumin ja ammoniakkikaasun reaktiolla[2], mutta yleensä käytetään kuitenkin nestemäistä ammoniakkia.[3]. Katalyyttinä käytetään rauta(III)nitraattia.
- 2 Na + 2 NH3 → 2 NaNH2 + H2
Reaktioita
[muokkaa | muokkaa wikitekstiä]Epäorgaanisia reaktioita
[muokkaa | muokkaa wikitekstiä]Natriumamidi reagoi hyvin voimakkaasti veden kanssa, jolloin muodostuu ammoniakkikaasua ja natriumhydroksidia[4]. Palaessaan aine muodostaa natriumperoksidia ja typen oksideita, kuten typpidioksidia.[2]
- NaNH2 + H2O → NH3 + NaOH
- 2NaNH2 + 4O2 → Na2O2 + 2 NO2 + 2H2O
Natriumamidia käytetään valmistettaessa natriumatsidia. Natriumamidi reagoi joko dityppimonoksidin tai natriumnitraatin kanssa tuottaen natriumatsidia.[4]
- 2 NaNH2 + N2O → NaN3 + NaOH + NH3
- 3 NaNH2 + NaNO3 → NaN3 + 3 NaOH + NH3
Aikaisemmin natriumamidia käytettiin myös natriumsyanidin valmistamiseen. Natriumamidi reagoi hiilen kanssa muodostaen natriumsyanamidia, joka muodostaa edelleen hiilen kanssa reagoidessaan natriumsyanidia.[3]
- 2 NaNH2 + C → Na2CN2 + H2
- Na2CN2 + C → 2 NaCN
Orgaanisia reaktioita
[muokkaa | muokkaa wikitekstiä]Natriumamidi aiheuttaa halogenoiduissa yhdisteissä eliminaatioreaktion, jossa halogeeniatomit poistuvat yhdisteestä halogeenivetynä. Tällöin yhdisteeseen syntyy kolmoissidos. Esimerkkinä fenyyliasetyleenin synteesi.[5]
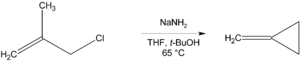
Jos β-asemassa ei ole vetyä liittyneenä hiileen, voi reaktio natriumamidin kanssa johtaa syklisen yhdisteen muodostumiseen. Esimerkissä syntyy metyleenisyklopropaania.[6]
Natriumamidia käytetään liittämään aminoryhmiä pyridiinirenkaaseen. Aminoryhmä kiinnittyy yleensä kakkoshiileen.[7]
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ Sodium amide PubChem. Viitattu 8.9.2024. (englanniksi)
- ↑ a b F. W. Bergstrom: Sodium amide Organic Syntheses. Viitattu 13.4.2009. (englanniksi)
- ↑ a b Egon Wiberg, Nils Wiberg, Arnold Frederick Holleman: Inorganic chemistry, s. 1266. Academic Press, 2001. ISBN 978-0-12-352651-9 Kirja Googlen teoshaussa (viitattu 13.4.2009). (englanniksi)
- ↑ a b Egon Wiberg, Nils Wiberg, Arnold Frederick Holleman: Inorganic chemistry, s. 1266. Academic Press, 2001. ISBN 978-0-12-352651-9 Kirja Googlen teoshaussa (viitattu 13.4.2009). (englanniksi)
- ↑ Kenneth N. Campbell & Barbara K. Campbell: Phenyl acetylene Organic Syntheses, Coll. Vol. 4, p.763 (1963). Organic Syntheses. Viitattu 13.4.2009. (englanniksi)
- ↑ J. R. Salaun, J. Champion & J. M. Conia: Cyclobutanone from methylenecyclopropane via oxaspiropentane Organic Syntheses, Coll. Vol. 6, p.320 (1988). Organic Syntheses. Viitattu 13.4.2009. (englanniksi)
- ↑ Alan R. Katritzky: Advances in Heterocyclic Chemistry, s. 42. Academic Press, 1989. ISBN 978-0120206445 Kirja Googlen teoshaussa (viitattu 13.4.2009). (englanniksi)