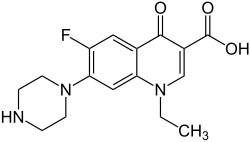
Norfloksasiini
| |

| |
Norfloksasiini
| |
| Systemaattinen (IUPAC) nimi | |
| 1-etyyli-6-fluori-4-okso-7-piperatsin-1-yylikinoliini-3-karboksyylihappo | |
| Tunnisteet | |
| CAS-numero | |
| ATC-koodi | J01 |
| PubChem CID | |
| DrugBank | |
| Kemialliset tiedot | |
| Kaava | C16H18N3FO3 |
| Moolimassa | 319,334 |
| SMILES | Etsi tietokannasta: , |
| Fysikaaliset tiedot | |
| Sulamispiste | 220–221 °C [1] |
| Liukoisuus veteen | 0,28 g/l[1] |
| Farmakokineettiset tiedot | |
| Hyötyosuus | 35–70[2] |
| Proteiinisitoutuminen | 14 %[3] |
| Metabolia | Hepaattinen |
| Puoliintumisaika | 4 h[2] |
| Ekskreetio | ? |
| Terapeuttiset näkökohdat | |
| Raskauskategoria |
? |
| Reseptiluokitus |
|
| Antotapa | Oraalinen |
Norfloksasiini (C16H18N3O3F) on fluorokinoloneihin kuuluva heterosyklinen orgaaninen yhdiste. Yhdistettä voidaan käyttää lääketieteessä antibioottina useiden bakteeri-infektioiden hoidossa.
Ominaisuudet
[muokkaa | muokkaa wikitekstiä]Huoneenlämpötilassa norfloksasiini on valkoista tai kellertävää hygroskooppista kiteistä ainetta.[1] Norfloksasiinin antibioottiset ominaisuudet perustuvat siihen, että se estää bakteerien DNA:n jakautumisessa tarvitsemia entsyymejä ja siten estää solujen jakaantumisen. Norfloksasiini on tehokas erityisesti aerobisia gramnegatiivisia bakteereja ja eräitä grampositiivisia bakteereja vastaan. Anaerobisiin bakteereihin se ei tehoa. Norfloksasiinia käytetään esimerkiksi bakteeriripulin, virtsarakontulehduksen, virtsatietulehdusten, silmätulehdusten, eturauhastulehduksen ja bakteerien aiheuttamien sukupuolitautien hoidossa. Norfloksasiini on osittain korvattu uudemmilla antibiooteilla.[2][3][4][5]
Tyypillisimmät norfloksasiinin aiheuttamat haittavaikutukset ovat pääkipu, huonovointisuus, huimaus ja maksaentsyymiarvojen kohoaminen. Yhdiste voi aiheuttaa maksa- tai haimatulehduksen. Norfloksasiinin käytön ja jänteiden repeämien välillä on osoitettu olevan yhteys.[3][6]
Valmistus
[muokkaa | muokkaa wikitekstiä]Norfloksasiinin synteesin ensimmäisessä vaiheessa 3-kloori-4-fluorianiliini reagoi dietyylietoksimetyleenimalonaatin kanssa substituutioreaktiolla. Kuumennettaessa tämä tuote syklisoituu ja muodostuu kinoliinijohdannainen. Tämä yhdiste reagoi bromietaanin kanssa ja esteriryhmä hydrolysoidaan emäksisissä olosuhteissa. Viimeisessä vaiheessa yhdiste reagoi piperatsiinin kanssa nukleofiilisella aromaattisella substituutiolla.[7]
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b c Susan Budavari (päätoim.): Merck Index, s. 1150. (12th Edition) Merck & Co., 1996. ISBN 0911910-12-3 (englanniksi)
- ↑ a b c Raimo K. Tuominen ja Pekka T. Männistö: 53. Nukleiinihappoihin vaikuttavat mikrobilääkkeet Farmakologia ja toksikologia. Medicina. Viitattu 1.10.2018.
- ↑ a b c M. Lindsay Grayson, Suzanne M. Crowe, James S. McCarthy, John Mills, Johan W. Mouton, S. Ragnar Norrby, David L. Paterson, Michael A. Pfaller: Kucers' The Use of Antibiotics, s. 2024–2051. CRC Press, 2010. ISBN 9780340927670 Kirja Googlen teoshaussa (viitattu 1.10.2018). (englanniksi)
- ↑ Paul Actor, Alfred W. Chow, Frank J. Dutko & Mark A. McKinlay: Chemotherapeutics, Ullmann's Encyclopedia of Industrial Chemistry, John Wiley & Sons, New York, 2000. Viitattu 1.10.2018
- ↑ Roger G. Finch,David Greenwood,Richard J. Whitley,S. Ragnar Norrby: Antibiotic and Chemotherapy, s. 314. Elsevier, 2010. ISBN 9780702047657 Kirja Googlen teoshaussa (viitattu 1.10.2018). (englanniksi)
- ↑ Jeffrey K. Aronson: Meyler's Side Effects of Antimicrobial Drugs, s. 953–960. Elsevier, 2009. ISBN 9780444532725 Kirja Googlen teoshaussa (viitattu 1.10.2018). (englanniksi)
- ↑ Ṛuben Vardanyan, Victor J. Hruby: Synthesis of essential drugs, s. 516. Elsevier, 2006. ISBN 978-0-444-52166-8 Kirja Googlen teoshaussa (viitattu 1.10.2018). (englanniksi)
