Peroksinitriitti
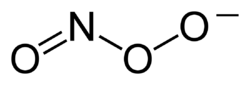
Peroksinitriitti tai peroksonitriitti on anioni, jonka kaava on ONOO-. Peroksinitriitti on hyvin vahva hapetin.
Peroksinitriitti-ioni on nitraatti-ionin isomeeri. Peroksinitriitti on peroksityppihapokkeen protonoitumisessa muodostuva ioni. Peroksityppihappo luovuttaa protoninsa noin pH:ssa 6,8. Ioni on vahva hapetin mutta suhteellisen pysyvä emäksisissä liuoksissa sekä eräät yhdisteet kiinteänäkin. Väriltään peroksinitriitti-ioneja sisältävät liuokset ovat keltaisia. Siitä muodostuu happokäsittelyllä peroksityppihapoketta, joka on pysymätön ja hajoaa muodostaen hydroksyyliradikaaleja. Peroksinitriittianionista on kaksi isomeerista muotoa, cis- ja trans-peroksinitriitti-ionit, joista cis-isomeeri on liuoksessa vallitseva. Typpiatomin ja peroksiryhmän hapen välillä on kaksoissidoksen luonnetta.[1][2][3]
Peroksinitriitti-ioneja muodostuu hapetettaessa nitriittisuoloja vetyperoksidin avulla. Tämän menetelmän seurauksena liuos sisältää epäpuhtautenaan muun muassa nitraatti-ioneja. Jotta tällä menetelmällä saataisiin nitriitti-ionit hapettumaan merkittävissä määrin peroksinitriitti-ioneiksi, reaktio on suoritettava 0 °C lämpötilassa. Peroksinitriittejä voidaan valmistaa myös fotokemiallisesti nitraateista UV-valoa käyttämällä tai röntgensäteiden tai elektronipommituksen seurauksena. Muita tapoja ovat natriumatsidin otsonointi ja nitriittiestereiden hydrolyysi emäksen avulla.[1][2][3][4]
Peroksinitriitti-ioni on suhteellisen pysyvä emäksisissä liuoksissa, esimerkiksi pH:ssa 12 useita kuukausia. Se muuntuu hitaasti nitraatti-ioniksi tai hajoaa nitriitti-ioniksi ja happikaasuksi. Peroksinitriitti-ioni on vahva hapetin ja kykenee hapettamaan esimerkiksi jodidi-ionin hypojodihapokkeeksi. Se pystyy hapettamaan myös esimerkiksi vetyperoksidin hapeksi. Pelkistyessään peroksinitriittianionista muodostuu nitriittianioni. Tietyissä tapauksessa ioni voi toimia myös pelkistimenä. Esimerkiksi permanganaatti-ioni hapettaa sen pelkistyen manganaatti-ioniksi.[1][2]
Biokemia
[muokkaa | muokkaa wikitekstiä]
Eliöissä peroksinitriittiä muodostuu superoksidi-ionien reagoidessa typpimonoksidin kanssa. Reaktio on nopea ja nopeampi kuin esimerkiksi superoksididismutaasin katalysoima superoksidin hajotusreaktio. Peroksinitriitti on voimakas hapetin ja hapettaa esimerkiksi kysteiiniaminohapon sivuketjujen tioliryhmiä, mikä voi johtaa toimimattomiin entsyymeihin. Se on myös voimakkaasti nitraava yhdiste, joka nitraa muun muassa proteiinien tyrosiiniaminohappoja. Se reagoi myös metioniini- selenokysteiiniaminohappojen kanssa. Peroksinitriitti-ionilla on havaittu olevan rooli muun muassa hermoston sairauksissa, tulehdussairauksissa sekä sydän- ja verisuonitaudeissa.[5][6]
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b c Norbert Steiner & Wilfried Eul :Peroxides and Peroxide Compounds, Inorganic Peroxides, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, New York, 2001 Teoksen verkkoversio Viitattu 14.01.2012
- ↑ a b c John O. Edwards & Robert C. Plumb: The Chemistry of Peroxonitrites, s. 600–633. (Teoksessa Progress in Inorganic Chemistry (toim. Kenneth D. Karlin)) John Wiley & Sons, 1994. ISBN 978-0-471-59699-8 Kirja Googlen teoshaussa (viitattu 14.01.2012). (englanniksi)
- ↑ a b W. H. Koppenol: The Chemistry of Peroxynitrite - A Biological Toxin. Química Nova, 1998, 21. vsk, nro 3. Artikkelin verkkoversio. Viitattu 14.1.2012. (englanniksi)
- ↑ D. Scott Bohle & Elisabeth S. Sagan: Tetramethylamoonium salts of superoxide and peroxynitrite, s. 36. (Teoksessa Inorganic Syntheses (toim. John R. Sharpley)) John Wiley & Sons, 2004. ISBN 978-0-471-64750-8 Kirja Googlen teoshaussa (viitattu 14.01.2012). (englanniksi)
- ↑ Louis J. Ignarro: Nitric oxide, s. 63. Academic Press, 2009. ISBN 978-0-12-373866-0 Kirja Googlen teoshaussa (viitattu 14.01.2012). (englanniksi)
- ↑ Carsten Schmuck, Helma Wennemers, Ronald Breslow: Highlights in Bioorganic Chemistry, s. 192. John Wiley & Sons, 2006. ISBN 978-3-527-60408-1 Kirja Googlen teoshaussa (viitattu 14.01.2012). (englanniksi)