Azoture de fluor
| Azoture de fluor | ||
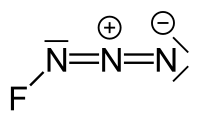
| ||
 | ||
| Identification | ||
|---|---|---|
| No CAS | ||
| PubChem | 23235952 | |
| SMILES | ||
| InChI | ||
| Apparence | gaz jaune-vert | |
| Propriétés chimiques | ||
| Formule | FN3 [Isomères] |
|
| Masse molaire[1] | 61,018 5 ± 0,000 6 g/mol F 31,14 %, N 68,86 %, |
|
| Propriétés physiques | ||
| T° fusion | −152 °C[2],[3] | |
| T° ébullition | −82 °C[2],[3] | |
| Masse volumique | 1,3 g·cm-3[4] | |
| Composés apparentés | ||
| Autres composés | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
L'azoture de fluor ou fluorure de triazadiényle est un gaz jaune vert composé d'azote et de fluor de formule brute FN3[2] qui a été synthétisé pour la première fois par John F. Haller en 1942[5]. Il est considéré comme un interhalogène, comme l'ion azoture est considéré comme un pseudohalogénure. De ce point de vue, il est homologue avec ClN3, BrN3, IN3[3]. La liaison entre l'atome de fluor et celui d'azote est très faible ce qui fait que ce composé est très instable et est susceptible d'exploser[6].
Structure
[modifier | modifier le code]Les atomes d'azote dans cette molécule peuvent être marqués avec des lettres grecques: Nα pour l'azote lié à l'atome de fluor, Nβ pour l'azote intermédiaire, et Nγ pour l'azote terminal[7]. L'azote terminal peut aussi être marqué Nω[6].
Les distances entre les atomes sont F-N 144,4 pm, FN-NN 125,3 pm et FNN-N 113,2 pm[8]. Des calculs de chimie numérique donne un angle F-N=N autour de 102° tandis que les trois atomes d'azote restent alignés[9].
Synthèse et propriété
[modifier | modifier le code]L'azoture de fluor peut être obtenu par réaction de l'acide azothydrique sur du gaz fluor, F2[10]. De la même façon, il se forme par réaction entre l'azoture de sodium et le fluor[11].
L'azoture de fluor se décompose sans explosion à température ambiante (CNTP) en difluorure de diazote et diazote[2]:
- 2 FN3 → F2N2 + 2 N2
À des températures plus élevées telles que 1 000 °C, l'azoture de fluor se décompose en radicaux monofluorure d'azote (en)[11] :
- FN3 → FN{a1Δ} + N2
L'azoture de fluor solide ou liquide est susceptible d'exploser en libérant beaucoup de chaleur. Un film mince brûle à une vitesse de 1,6 km/s[12]. En raison de ce risque élevé d'explosion, il est recommandé de ne manipuler que de très petites quantités à la fois. Ainsi, 20 mg (0,02 g) est la limite définie pour chaque expérience[8].
Spectroscopie
[modifier | modifier le code]en spectrométrie micro-onde :
| paramètre | valeur[8] | unité |
| A | 48131.448 | MHz |
| B | 5713.266 | MHz |
| C | 5095.276 | MHz |
| μa | 1.1 | |
| μb | 0.7 |
Le spectre photoélectronique ultraviolet de FN3 montre des pics d'ionisation à 11.01, 13,72, 15,6, 15,9, 16,67, 18,2 et 19,7 eV. Ceux-ci sont respectivement affectés aux orbitales moléculaires: π, nN ou nF, nF, πF, nN ou σ, π et σ[6].
Réaction
[modifier | modifier le code]Le N3F peut former des adduits avec des acides de Lewis comme le trifluorure de bore (BF3) ou le pentafluorure d'arsenic (AsF5) à −196 °C (azote liquide). Dans ces molécules, la liaison se fait sur l'atome Nα[7].
Le N3F s'adsorbe sur une surface de fluorure de potassium, mais pas sur le fluorure de lithium ou sur le fluorure de sodium. Cette propriété a été objet d'une étude approfondie pour déterminer si N3F pouvait augmenter l'énergie des propergols solides[4].
Notes et références
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Fluorine azide » (voir la liste des auteurs).
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Edward Gipstein, John F. Haller, Absorption Spectrum of Fluorine Azide, Applied Spectroscopy, 1966, vol. 20(6), pp. 417–418. DOI 10.1366/000370266774386470, (ISSN 0003-7028).
- P. B. Saxena, Chemistry of Interhalogen Compounds, Discovery Publishing House, 2007, p. 96. (ISBN 9788183562430).
- Nathan E. Brener, Neil R. Kestner, Joseph Callaway, Theoretical Studies of Highly Energetic CBES Materials: Final Report for the Period 2 March 1987 to 31 May 1987, Louisiana State University, Department of Physics and Astronomy, pp. 21–27.
- ↑ Derek Lowe, I Won't Work With: Triazadienyl Fluoride sur pipeline.corante.com
- Paul Rademacher, Andreas J. Bittner, Gabriele Schatte, Helge Willner, Photoelectron Spectrum and Electronic Structure of Triazadienyl Fluoride, N3F, Chemische Berichte, 1988, vol. 121(3), p. 555–557. DOI 10.1002/cber.19881210325, (ISSN 0009-2940).
- G. Schatte, H. WIllner, Die Wechselwirkung von N3F mit Lewis-Säuren und HF. N3F als möglicher Vorläufer für die Synthese von N3+-Salzen, Zeitschrift für Naturforschung. B, 1991, vol. 46(4), p. 483–489. (ISSN 0932-0776).
- Dines Christen, H. G. Mack, G. Schatte, H. Willner, Structure of triazadienyl fluoride, FN3, by microwave, infrared, and ab initio methods, Journal of the American Chemical Society, 1988, vol. 110(3), p. 707–712. DOI 10.1021/ja00211a007, (ISSN 0002-7863).
- ↑ Nancy J. S. Peters, Leland C. Allen, Raymond A. Firestone, Fluorine azide and fluorine nitrate: structure and bonding, Inorganic Chemistry, 1988, vol.27(4), p. 755–758. DOI 10.1021/ic00277a035, (ISSN 0020-1669).
- ↑ Khodayar Gholivand, Gabriele Schatte, Helge Willner, Properties of triazadienyl fluoride, N3F, Inorganic Chemistry, 1987, vol. 26(13), p. 2137–2140. DOI 10.1021/ic00260a025, (ISSN 0020-1669).
- D. J. Benard, B. K. Winker, T. A. Seder, R. H. Cohn, Production of nitrogen monofluoride (a1Δ) by dissociation of fluorine azide, The Journal of Physical Chemistry, 1989, vol. 93(12), p. 4790–4796. DOI 10.1021/j100349a022, (ISSN 0022-3654).
- ↑ T.A. Seder, D.J. Benard, The decomposition of condensed phase fluorine azide, Combustion and Flame, 1991, vol. 85(3-4) p. 353–362. DOI 10.1016/0010-2180(91)90139-3, (ISSN 0010-2180).