Bistriflimidure
| Bistriflimidure | |
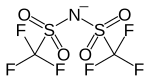
| |
| Structure de l'anion bistriflimidure | |
| Identification | |
|---|---|
| Nom UICPA | 1,1,1-trifluoro-N-(trifluorométhylsulfonyl)- méthanesulfonimidate |
| Synonymes |
bis(trifluorométhane)sulfonimidure, |
| No CAS | anion : acide : |
| No ECHA | 100.103.349 |
| No CE | acide : 435-300-4 |
| PubChem | anion : 4176748 acide : 157857 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C2F6NO4S2 |
| Masse molaire[1] | 280,146 ± 0,013 g/mol C 8,57 %, F 40,69 %, N 5 %, O 22,84 %, S 22,89 %, |
| Précautions | |
| SGH[2] | |
| H301, H314, H318, P260, P264, P270, P280, P321, P330, P363, P301+P330+P331, P304+P340, P405 et P501 |
|
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le bistriflimidure, ou bistriflimide par anglicisme, abrégé TFSI ou NTf2, est un anion non coordinant de formule chimique [N(SO2CF3)2]−. C'est la base conjuguée de l’acide bistriflimidique HN(SO2CF3)2. Ses sels sont généralement désignés comme triflimidures ou triflimidates de métaux (en), à l'instar du bis(trifluorométhanesulfonyl)imidure de lithium Li+ [N(SO2CF3)2]−.
Applications
[modifier | modifier le code]Cet anion intervient dans les liquides ioniques tels que le bis(trifluorométhylsulfonyl)imidure de trioctylméthylammonium (en) dans la mesure où il est plus stable et moins toxique que des contre-ions plus courants comme le tétrafluoroborate BF4−. Il est également important dans les accumulateurs lithium-ion et les accumulateurs lithium-métal (en) — par exemple sous forme de LiTSFI, correspondant au sel Li+ [N(SO2CF3)2]− — en raison de sa dissociation et de sa conductivité élevées. Il présente l'avantage de réduire le taux de cristallinité du polyéthylène glycol, ce qui accroît la conductivité de ce polymère en-dessous de son point de fusin à 50 °C.
Acide bistriflimidique
[modifier | modifier le code]L'acide conjugué de l'anion bistrifimidure est généralement désigné sous le nom d'acide bistriflimidique, de formule HN(SO2CF3)2. Il s'agit d'un superacide, distribué dans le commerce sous la forme d'un solide cristallisé hygroscopique. Son acidité élevée et sa bonne compatibilité avec les solvants organiques en font un catalyseur employé dans une large gamme de réactions[3]. La valeur de son pKa dans l'eau ne peut être déterminée précisément mais a été estimée à −0,10 dans l'acétonitrile CH3CN et à −12,3 dans le 1,2-dichloroéthane CH2Cl–CH2Cl (par rapport au pKa de l'acide picrique (2,4,6‑trinitrophénol) (NO2)3C6H2–OH normalisé à zéro pour approcher l'échelle de pKa en solution aqueuse[4]), ce qui le rend plus acide que l'acide trifluorométhanesulfonique CF3SO3H (acide triflique, avec pKaMeCN = 0,70, pKaDCE(par rapport à l'acide picrique) = −11,4)[5].
-
Acide bistriflimidique.
-
Échantillon.
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « 1,1,1-Trifluoro-N-((trifluoromethyl)sulfonyl)methanesulfonamide », sur pubchem.ncbi.nlm.nih.gov, NIH > NLM > NCBI > PubChem (consulté le ).
- (en) Wanxiang Zhao et Jianwei Sun, « Triflimide (HNTf2) in Organic Synthesis », Chemical Reviews, vol. 118, no 20, , p. 10349-10392 (PMID 30251840, DOI 10.1021/acs.chemrev.8b00279, S2CID 52815855, lire en ligne).
- Les valeurs de pKa absolues dans le 1,2-dichloroéthane sont plus élevées d'environ 45 unités, ce qui correspond à des valeurs très élevées comparables aux plus forts des superacides ; voir : (en) Lauri Lipping, Ivo Leito, Ivar Koppel, Ingo Krossing, Daniel Himmel et Ilmar A. Koppel, « Superacidity of closo-Dodecaborate-Based Brønsted Acids: a DFT Study », The Journal of Physical Chemistry A, vol. 119, no 4, , p. 735-743 (PMID 25513897, DOI 10.1021/jp506485x, Bibcode 2015JPCA..119..735L, lire en ligne).
- (en) Elin Raamat, Karl Kaupmees, Gea Ovsjannikov, Aleksander Trummal, Agnes Kütt, Jaan Saame, Ivar Koppel, Ivari Kaljurand, Lauri Lipping, Toomas Rodima, Viljar Pihl, Ilmar A. Koppel et Ivo Leito, « Acidities of strong neutral Brønsted acids in different media », Journal of Physical Organic Chemistry, vol. 26, no 2, , p. 162-170 (DOI 10.1002/poc.2946, lire en ligne).



