Blastocystis
Les quatre formes de Blastocystis hominis
| Domaine | Eucaryote |
|---|---|
| Règne | Chromalveolata |
| Division | Heterokonta |
| Classe | Blastocystae |
| Ordre | Blastocystida |
| Famille | Blastocystidae |
Blastocystis est un genre de protozoaires unicellulaires du groupe des straménopiles (ou Heterokonta) qui inclut des algues, les diatomées et les oomycètes.
Les nombreuses espèces du genre Blastocystis se rencontrent dans le système tractus gastro-intestinal d'espèces aussi diverses que l'Homme, les animaux de ferme, les oiseaux, les rongeurs, les reptiles, les amphibiens, les poissons et les cafards[1]. La maladie hydrique qu'ils peuvent provoquer est appelée blastocystose.
Morphologie
[modifier | modifier le code]Les espèces du genre Blastocystis ont des morphologies variées. Quatre formes sont souvent décrites : vacuolaire, granulaire, amiboïde et kyste. La morphologie de l'organisme dépend largement des conditions environnementales notamment de l'oxygène. La présence de toutes ces formes dans l'intestin de l'hôte n'est pas claire.
- Forme vacuolaire - c'est la forme typique de la cellule de Blastocystis vue en culture et est souvent utilisée pour l'identification de l'organisme. Ces formes vacuolaires varient considérablement en taille, avec un diamètre allant de 2 µm à 200 µm. La forme vacuolaire dispose d'une grande vacuole entourée d'une mince bande de cytoplasme contenant d'autres organites. La fonction de la vacuole n'est pas encore claire, cependant, il a été suggéré que, comme pour de nombreuses cellules eucaryotes, cette vacuole serve à des fins de stockage.
- Forme granulaire - cette forme, relativement semblable aux formes vacuolaires, à l'exception du fait que des granules sont observées dans la vacuole centrale et/ou dans le cytoplasme. Dans la vacuole centrale, ces granules apparaissent également sous des formes différentes. Trois types ont été suggérés - métaboliques, lipidique, et des granules de reproduction. Les granules métaboliques jouent un rôle dans les processus chimiques nécessaires pour la vie de l'organisme. Il a également été avancé que les granules de reproduction sont impliquées dans le développement des cellules filles. Ces hypothèses sont uniquement fondées sur la microscopie, et doivent donc loin d'être confirmées. Il a également été suggéré que les granules soient une conséquence de l'apoptose.
- Forme amiboïde - cette forme n'est pas mobile et fortement adhésive. Une étude a rapporté que les formes amiboïdes ne sont produites que dans les cultures provenant des patients symptomatiques, alors que les isolats de patients asymptomatiques produisent exclusivement des formes vacuolaires. L'étude a suggéré que cette méthode pourrait être utilisée pour diagnostiquer une infection symptomatique. En outre, elle a suggéré que les symptômes peuvent être dus à l'accumulation des formes amiboïdes fortement adhésives sur la paroi intestinale de l'hôte. Une étude détaillée ultra-structurale des formes amiboïdes a été publiée en 2007[2].
- Forme de kyste - cette forme a été découverte plus récemment et a contribué à l'avancement de la compréhension de la transmission. Comparé aux autres formes, il est généralement de plus petite taille et a une paroi épaisse. Il est dépourvu de grande vacuole centrale mais quelques noyaux, des vacuoles multiples et des dépôts de stockage de nutriments y ont été observés. Le kyste est la forme la plus résistante de ce parasite et est capable de survivre dans des conditions difficiles grâce à son épaisse paroi. Des expériences ont été menées pour démontrer sa capacité à résister aux suc gastriques. En outre, les kystes ne sont pas lysés dans l'eau distillée et pourraient bien survivre à température ambiante pendant près de 19 jours[3],[4]. Il a de plus été montré que les kystes pouvaient survivre sur un milieu contenant des antibiotiques antiparasitaires.
Cycle de vie
[modifier | modifier le code]Le cycle de vie présumé commence avec l'ingestion de kystes. Après ingestion, le kyste se transforme vers les autres formes qui peuvent à leur tour se transformer de nouveau en kystes. Ces kystes sont relâchés dans l'environnement extérieur par les excréments et sont transmis à l'Homme et à d'autres animaux par la voie fécale-orale pour répéter l'ensemble du cycle.
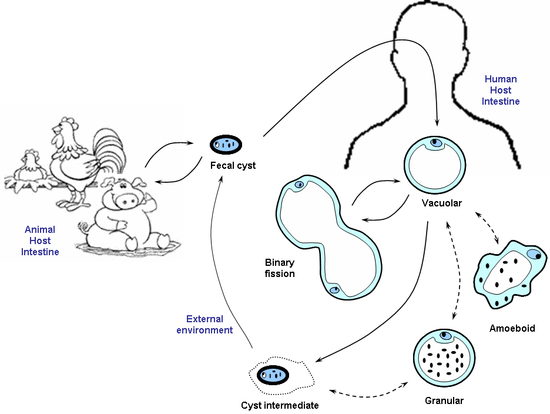
- Obtention et culture de Blastocystis
L'ATCC conserve une collection d'isolats de Blastocystis. Des milieux de cultures solides ou liquides pour Blastocystis ont été définis[6],[7].
Pathologie
[modifier | modifier le code]Les infections par les protozoaires sont les parasitoses les plus fréquentes, notamment en milieu tropical. Celle par Blastocystis sp. (anciennement Blastocystis hominis) peut être asymptomatique ou symptomatique. Elle se traduit alors par des douleurs intestinales permanentes ou récurrentes et des flatulences, Elle peut également causer des diarrhées et de céphalées intermittentes[8].
Le véhicule de transmission le plus fréquent des kystes étant l'eau, la prévention consiste dans les zones où l'eau est susceptible d'être contaminée à ne la consommer que bouillie.
La blastocystose peut être traitée par le secnidazol. Il est toutefois difficile d'éradiquer Blastocystis sp. notamment dans le cadre de co-infections, comme avec Cryptosporidium ou Strongyloides tercoralis. Des protocoles plus complexes doivent alors être mis en œuvre[8].
Organites
[modifier | modifier le code]Les organites de Blastocystis ressemblant à des mitochondries sont une énigme dans la mesure où l'organisme a un métabolisme anaérobie strict. Des analyses récentes des séquences du génome de l'organite et plus de 12 000 EST ont révélé de nombreuses fonctions jouées par cet organite dans le métabolisme de la cellule. Le génome code plusieurs sous-unités de la NADH déshydrogénase (complexe I), mais est dépourvu de toute trace de gènes codants le cytochrome et la sous-unité ATPase (Complexe III-V) (voir chaîne respiratoire). Les EST ont confirmé la présence des complexes I et II, et indiquent que cette chaîne respiratoire partielle peut conduire à une oxydase alternative. Les EST suggèrent également que de nombreuses autres voies métaboliques caractéristiques des mitochondries sont encore présents dans les organites de Blastocystis. Toutefois, d'autres constatations montrent que l'organite a également des caractéristiques communes avec les hydrogénosomes.
Notes et références
[modifier | modifier le code]- (en) Yoshikawa H, Wu Z, Howe J, Hashimoto T, Geok-Choo N, Tan KS, « Ultrastructural and phylogenetic studies on Blastocystis isolates from cockroaches », The Journal of Eukaryotic Microbiology, vol. 54, no 1, , p. 33–7 (PMID 17300516, DOI 10.1111/j.1550-7408.2006.00141.x)
- (en) Tan TC, Suresh KG, « Amoeboid form of Blastocystis hominis - a detailed ultrastructural insight », Parasitology Research, vol. 99, no 6, , p. 737–42 (PMID 16816959, DOI 10.1007/s00436-006-0214-z)
- (en) Zaman V, Howe J, Ng M, « Ultrastructure of Blastocystis hominis cysts », Parasitology Research, vol. 81, no 6, , p. 465–9 (PMID 7567903, DOI 10.1007/BF00931787)
- (en) Moe KT, Singh M, Howe J, et al., « Observations on the ultrastructure and viability of the cystic stage of Blastocystis hominis from human feces », Parasitology Research, vol. 82, no 5, , p. 439–44 (PMID 8738284, DOI 10.1007/s004360050142)
- (en) Tan KS, « Blastocystis in humans and animals: new insights using modern methodologies », Veterinary Parasitology, vol. 126, nos 1-2, , p. 121–44 (PMID 15567582, DOI 10.1016/j.vetpar.2004.09.017)
- (en) Tan SW, Singh M, Yap EH, et al., « Colony formation of Blastocystis hominis in soft agar », Parasitology Research, vol. 82, no 4, , p. 375–7 (PMID 8740557, DOI 10.1007/s004360050130)
- (en) Tan SW, Singh M, Thong KT, et al., « Clonal growth of Blastocystis hominis in soft agar with sodium thioglycollate », Parasitology Research, vol. 82, no 8, , p. 737–9 (PMID 8897510, DOI 10.1007/s004360050194)
- Nathalie Chacón, Carmen Durán, María Antonia De la Parte (Universidad Central de Venezuela), « Blastocystis sp. en humanos: actualización y experiencia clínico-terapéutica », Caracas, Boletín Venezolano de Infectología, vol. 28, nº 1, p. 5-14, janvier-juin 2017, lire en ligne, consulté le 16 janvier 2024
Liens externes
[modifier | modifier le code]- (en) Référence BioLib : Blastocystis (Alexieff, 1911) Brumpt, 1912 (consulté le )
- (en) Référence Catalogue of Life : Blastocystis (consulté le )
- (en) Référence NCBI : Blastocystis (taxons inclus) (consulté le )
- (en) Référence WoRMS : Blastocystis Alexeieff (+ liste espèces) (consulté le )
- CDC description of Blastocystis hominis
- Blastocystis Research Foundation

