Bétalaïne

Les bétalaïnes sont des pigments végétaux, dont la couleur varie d’un jaune foncé à un violet intense.
Source
[modifier | modifier le code]
Les bétalaïnes sont présentes dans la plupart des familles de plantes appartenant à l’ordre des Caryophyllales. L’exemple le plus connu de ces plantes est la betterave rouge (Beta vulgaris, appelée parfois de manière erronée carotte rouge), mais des fleurs aussi populaires que les belles-de-nuit (mirabilis), les cactus (pitahaya[1], Figuier de Barbarie[2]), les bougainvilliers, les pourpiers[3] (Portulaca grandiflora) sont colorés par ces pigments. Certains champignons comme les Amanites (parmi lesquelles l’Amanite tue-mouche - Amanita muscaria) et les Hygrocybes doivent leur couleur jaune ou rouge aux bétalaïnes.
Chimie
[modifier | modifier le code]Le nom des « bétalaïnes » provient du nom latin de la betterave (Beta vulgaris), à partir de laquelle elles ont été la première fois extraites et caractérisées en 1958 par une équipe de l’École polytechnique fédérale de Zürich[4].
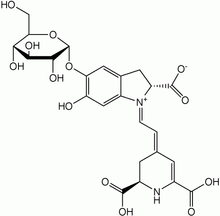
Les bétalaïnes sont des hétérosides, une partie de la molécule (chromophore) est attachée à un ose (sucre simple). Le chromophore dérive de l’acide aminé tyrosine par une synthèse complexe faisant intervenir comme intermédiaire la dihydroxyphénylalanine (DOPA).
Il existe deux catégories de bétalaïne[5] :
- Les bétacyanines, pigments de couleur rouge à violet (bétanine) ;
- Les bétaxanthines, pigments de couleur jaune à orange (indicaxanthine)[2].
La couleur et la stabilité des bétalaïnes dépendent du pH.
La plus étudiée des bétalaïnes est la bétanine (ou bétacyanine) aussi appelée rouge betterave car elle peut être isolée à partir de la betterave. Elle est commercialisée comme un colorant naturel pour colorer les aliments. Cependant, le monde de l’agroalimentaire s’y intéresse pour ses propriétés antioxydantes[6],[7] avec tous les bénéfices positifs pour la santé[2].
Les autres bétalaïnes connues sont l’amaranthine et l’isoamaranthine, toutes les deux isolées de plantes du genre des amaranthes (Amaranthus spp).
Génétique moléculaire
[modifier | modifier le code]La biosynthèse des bétalaïnes, à partir de l’acide aminé tyrosine, suit le schéma présenté dans la figure suivante : [1].
Dans la première étape de la voie de biosynthèse, la L-tyrosine est transformée en L-3,4-dihydroxyphénylalanine (L-dopa) par 3-hydroxylation au moyen d'une enzyme cytochrome P450[8]. Dans le cas de la dopa, la biosynthèse se ramifie : a) d'une part, son oxydation se fait au moyen d'une enzyme CYP pour former la cyclo-dopa[9] b) d'autre part, le cycle aromatique de la dopa est ouvert par une dopa-4,5-dioxygénase[10] pour former la seco-dopa, à partir de laquelle il se forme de l'acide bétalamique par recyclisation spontanée. Celui-ci réagit alors d'une part spontanément avec la cyclo-dopa pour former la bétanidine, ou d'autre part après sa glucosylation préalable par une cyclo-dopa-glucosyltransférase[11] pour former la bétanine rouge-violette, le bétacyan le plus simple. En outre, l'acide bétalamique réagit spontanément avec différents acides aminés ou amines pour former des bétaxanthines de couleur jaune-orange (voir illustration). La diversité des bêtacyanes résulte de la glucosylation différente de la bêta-anidine et de son acylation ultérieure avec des acides carboxyliques aliphatiques et aromatiques.
Notes et références
[modifier | modifier le code]- (en) FC Stintzing, A Schieber and R Carle (2002). Betacyanins in fruits from red-purple pitaya, Hylocereus polyrhizus (Weber) Britton & Rose. Food chemistry, vol. 77, no1, pp. 101-106
- (en) Luisa Tesoriere, Mario Allegra, Daniela Butera et Maria A. Livrea, « Absorption, excretion, and distribution of dietary antioxidant betalains in LDLs: potential health effects of betalains in humans », American Journal of Clinical Nutrition, vol. 80, no 4, , p. 941-945 (lire en ligne)
- (en) Trezzini GF, Zrÿd J-P (1990) Portulaca grandiflora: a model system for study of the biochemistry and genetics of betalain synthesis. Acta Horticulturae 280: 581-585
- (de) Wyler H, Vincenti G, Mercier M, Sassu G, Dreiding AS (1959) Zur Konstitution des Randenfarbstoffes Betanin.2. Helvetica Chimica Acta 42: 1696-1698
- (en) Frank B. Salisbury et Cleon W. Ross, Plant Physiology, Belmont, California, Wadsworth Publishing, , 4e éd. (ISBN 978-0-534-15162-1, LCCN 91007362), p. 325-326
- (en) J. Escribano, M. A. Pedreño, F. García-Carmona et R. Muñoz, « Characterization of the antiradical activity of betalains from Beta vulgaris L. roots », Phytochem. Anal., vol. 9, , p. 124–127
- (en) Erick L. Bastos et Willibald Schliemann, « Betalains as Antioxidants », dans Plant Antioxidants and Health, Springer International Publishing, , 1–44 p. (ISBN 978-3-030-45299-5, DOI 10.1007/978-3-030-45299-5_9-2, lire en ligne)
- (en) Gregory J Hatlestad, Rasika M Sunnadeniya, Neda A Akhavan et Antonio Gonzalez, « The beet R locus encodes a new cytochrome P450 required for red betalain production », Nature Genetics, vol. 44, no 7, , p. 816–820 (ISSN 1061-4036 et 1546-1718, DOI 10.1038/ng.2297, lire en ligne, consulté le )
- (en) Guy Polturak, Dario Breitel, Noam Grossman et Alejandro Sarrion‐Perdigones, « Elucidation of the first committed step in betalain biosynthesis enables the heterologous engineering of betalain pigments in plants », New Phytologist, vol. 210, no 1, , p. 269–283 (ISSN 0028-646X et 1469-8137, DOI 10.1111/nph.13796, lire en ligne, consulté le )
- Laurent Christinet, Frédéric X. Burdet, Maïa Zaiko et Ursula Hinz, « Characterization and Functional Identification of a Novel Plant 4,5-Extradiol Dioxygenase Involved in Betalain Pigment Biosynthesis in Portulaca grandiflora », Plant Physiology, vol. 134, no 1, , p. 265–274 (ISSN 1532-2548 et 0032-0889, DOI 10.1104/pp.103.031914, lire en ligne, consulté le )
- (en) Nobuhiro Sasaki, Taiji Adachi, Takatoshi Koda et Yoshihiro Ozeki, « Detection of UDP–glucose: cyclo ‐DOPA 5‐ O ‐glucosyltransferase activity in four o'clocks ( Mirabilis jalapa L.) », FEBS Letters, vol. 568, nos 1-3, , p. 159–162 (ISSN 0014-5793 et 1873-3468, DOI 10.1016/j.febslet.2004.04.097, lire en ligne, consulté le )