Chlorure de thionyle
| Chlorure de thionyle | |||

| |||
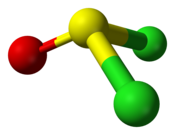 | |||
| Structure du chlorure de thionyle. | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | Dichlorure de thionyle | ||
| No CAS | |||
| No ECHA | 100.028.863 | ||
| No CE | 231-748-8 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide fumant incolore a jaune ou rouge, d'odeur acre[1]. | ||
| Propriétés chimiques | |||
| Formule | SOCl2 | ||
| Masse molaire[4] | 118,97 ± 0,009 g/mol Cl 59,6 %, O 13,45 %, S 26,95 %, |
||
| Moment dipolaire | 1,45 ± 0,03 D[2] | ||
| Diamètre moléculaire | 0,489 nm[3] | ||
| Propriétés physiques | |||
| T° fusion | −104,5 °C[1] | ||
| T° ébullition | 76 °C[1] | ||
| Solubilité | dans l'eau : réaction[1] | ||
| Paramètre de solubilité δ | 19,8 J1/2·cm-3/2 (25 °C)[3] | ||
| Pression de vapeur saturante | à 25 °C : 16 kPa[1] | ||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 10,96 eV (gaz)[5] | ||
| Propriétés optiques | |||
| Indice de réfraction | 1,516[3] | ||
| Précautions | |||
| SGH[6] | |||
| H302, H314, H332, EUH014 et EUH029 |
|||
| SIMDUT[7] | |||
   D1A, E, F, |
|||
| NFPA 704 | |||
| Transport | |||
|
|||
| Écotoxicologie | |||
| DL50 | 500 ppm (rats, inhalation) | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Le chlorure de thionyle, ou dichlorure de thionyle, est un composé inorganique de la famille des oxychlorures, de formule SOCl2. Il s'agit d'un réactif utilisé dans les réactions de chloration. C'est un liquide incolore qui se décompose vers 140 °C et réagit avec l'eau H2O en libérant du chlorure d'hydrogène HCl et du dioxyde de soufre SO2 :
La molécule de SOCl2 est pyramidale, ce qui indique la présence d'un doublet non liant sur l'atome de soufre (IV).
Synthèse
[modifier | modifier le code]La plupart des synthèses industrielles du chlorure de thionyle utilisent la réaction entre le trioxyde de soufre et le dichlorure de soufre.
Parmi les autres méthodes, on peut citer :
La réaction (a) a aussi pour produit de l'oxychlorure de phosphore, qui ressemble beaucoup au chlorure de thionyle dans de nombreuses réactions.
Utilisation
[modifier | modifier le code]Le principal emploi du chlorure de thionyle est en réactif de chloration. Il permet notamment de transformer les alcools en chlorures d'alkyle, selon l'équation :
- ROH + SOCl2 → RCl + SO2 + HCl
De même, les acides carboxyliques sont transformés en chlorures d'acyle :
- RCO2H + SOCl2 → RCOCl + SO2 + HCl
Voir aussi
[modifier | modifier le code]Liens externes
[modifier | modifier le code]Références
[modifier | modifier le code]- CHLORURE DE THIONYLE, Fiches internationales de sécurité chimique
- ↑ (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ « Chlorure de thionyle » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009



