Chromocène
| Chromocène | |
  |
|
| Identification | |
|---|---|
| Nom UICPA | chromocène |
| Synonymes |
bis(η5-cyclopentadiényl)chrome |
| No CAS | |
| No ECHA | 100.013.670 |
| No CE | 215-036-4 |
| No RTECS | GB7600000 |
| SMILES | |
| InChI | |
| Apparence | cristaux rouge foncé |
| Propriétés chimiques | |
| Formule | Cr(C5H5)2 |
| Masse molaire[1] | 182,182 5 ± 0,009 3 g/mol C 65,93 %, H 5,53 %, Cr 28,54 %, |
| Propriétés physiques | |
| T° fusion | 168 à 170 °C[2] |
| Précautions | |
| SIMDUT[2] | |
| Directive 67/548/EEC[2] | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
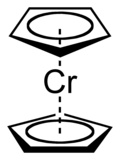
Le chromocène est un composé organochromique (en) de formule Cr(C5H5)2. On le désigne couramment sous l'abréviation Cp2Cr. Il a été décrit pour la première fois en 1953[3].
Propriétés
[modifier | modifier le code]
Le chromocène se présente sous la forme de cristaux rouge foncé. C'est un composé sandwich similaire au ferrocène, mais qui ne suit pas la règle des 18 électrons car il n'en possède que 16[4]. Sa structure a été vérifiée par cristallographie aux rayons X ; la longueur moyenne de la liaison Cr-C est de 215,1(13) pm[5],[6]. Comme le ferrocène, il existe en deux conformations, décalée ou éclipsée[6]. Dans la littérature, l'énergie de dissociation de la liaison C-Cr varie entre 179 kJ·mol−1 et 279 kJ·mol−1[6],[7].
Il est paramagnétique et hautement réducteur. Comme les autres métallocènes proches, le chromocène se sublime rapidement sous vide et est soluble dans les solvants organiques apolaires. Il est très réactif dans l'eau et dans l'air[8],[6] et peut s'enflammer spontanément au contact de l'air.
Synthèse
[modifier | modifier le code]Le chromocène est préparé à partir du chlorure de chrome(II) et du cyclopentadiénure de sodium.
En général, la première étape est la formation du chlorure de chrome(II) anhydre à partir du chrome et du chlorure d'hydrogène[9] :
Le chlorure de chrome ainsi préparé est mis à réagir avec le NaCp :
De telles synthèses sont généralement effectuées dans le THF.
Le décaméthylchromocène (Cr[C5(CH3)5]2), un analogue réducteur fort, est préparé de façon similaire à partir de LiC5(CH3)5.
Applications
[modifier | modifier le code]Comme pour les autres métallocènes, les ligands C5H5 sont déplaçables dans le chromocène. Associé au gel de silice, le chromocène donne le catalyseur d'Union Carbide utilisé pour la polymérisation de l'éthylène (même s'il existe d'autres moyens de préparer cet important catalyseur). Le chromocène se décompose sur la surface de la silice, produisant des centres organométalliques hautement réactifs responsables de l'activité catalytique.
Sécurité
[modifier | modifier le code]Les composés du chrome sont toxiques, même si les espèces Cr(VI) sont habituellement considérées plus dangereuses que les composés du chrome réduits. Le chromocène est hautement réactif avec l'air et peut s'enflammer en cas d'exposition à l'atmosphère.
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Bis(cyclopentadienyl)chromium(II), consultée le 11 octobre 2012.
- E. O. Fischer, W. Hafner: Z. Naturforsch. 1953, 8b, S. 444–445.
- C. Elschenbroich, A. Salzer, Organometallics: A Concise Introduction (2e éd.) (1992) de Wiley-VCH, Weinheim. (ISBN 3-527-28165-7)
- Kevin R. Flower, Peter B. Hitchcock, Crystal and molecular structure of chromocene (η5-C5H5)2Cr, Journal of Organometallic Chemistry, 1996, vol. 507, p. 275-277. DOI 10.1016/0022-328X(95)05747-D.
- (de) Arnold F. Holleman, Egon Wiberg, Nils Wiberg, Lehrbuch der anorganischen Chemie, p. 1 699–1 700, de Gruyter Verlag 1995 (ISBN 3-11-012641-9)
- (de) James E. Huheey, Ellen A. Keiter, Richard Keiter, Anorganische Chemie: Prinzipien von Struktur und Reaktivität, p. 797, de Gruyter Verlag, 2003 (ISBN 3-11-017903-2)
- (de) Christoph Elschenbroich, Organometallchemie, p. 452, B. G. Teubner Verlag, 2008 (ISBN 978-3-8351-0167-8)
- [PDF] (de) Chromocen
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Chromocene » (voir la liste des auteurs) et en allemand « Chromocen » (voir la liste des auteurs).
