Difluorure de dioxygène
| Difluorure de dioxygène | |
  |
|
| Structure du difluorure de dioxygène | |
| Identification | |
|---|---|
| No CAS | |
| PubChem | 123257 |
| ChEBI | 47866 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | O2F2 |
| Masse molaire[1] | 69,995 6 ± 0,000 6 g/mol F 54,28 %, O 45,72 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le difluorure de dioxygène est le composé du fluor de formule O2F2. Sous sa forme solide, il est de couleur orange et fond à −163 °C en un liquide rouge[2]. C'est un puissant oxydant qui se décompose en difluorure d'oxygène OF2 et oxygène O2 même à −160 °C (4 % par jour)[3].
Préparation
[modifier | modifier le code]Le difluorure de dioxygène peut être obtenu un injectant un mélange 1:1 de fluor gazeux et d'oxygène à basse pression (7–17 mmHg est optimal) avec une décharge électrique de 25–30 mA à 2,1–2,4 kV. C'est la réaction utilisée lors de la première synthèse de difluorure de dioxygène par Otto Ruff en 1933[4]. Une autre synthèse est un mélange d'oxygène O2 et de fluor F2 dans un récipient en acier inoxydable refroidit à −196 °C, suivi par une exposition à rayonnement continu de freinage de 3 MeV pendant plusieurs heures.
Structure
[modifier | modifier le code]Dans O2F2, l'état d'oxydation de l'oxygène, de +1, est inhabituel. Dans la plupart des autres composés, l’état d'oxydation de l'oxygène est de -2.
La structure du difluorure de dioxygène ressemble à celle du peroxyde d'hydrogène H2O2, dans son angle dièdre, qui approche 90°. Cette géométrie est conforme aux prédictions de la théorie VSEPR.
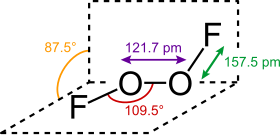
Les liaisons dans le difluorure de dioxygène ont fait l'objet de nombreuses spéculations au cours des années, en particulier à cause de la très courte longueur de la liaison O–O et des longues liaisons O–F. Bridgeman a proposé une structure dans laquelle O–O a une liaison triple et O–F une liaison simple qui est déstabilisée et allongée par la répulsion entre les doublets non liants des atomes de fluor et la liaison π O–O[5]. Cette répulsion est aussi la cause de la longueur et de la faiblesse du rayon de covalence de la molécule (en). Le déplacement chimique RMN 19F du difluorure de dioxygène est de 865 ppm, ce qui est de loin le plus grand déplacement chimique enregistré pour un atome de fluor, soulignant ainsi les extraordinaires propriétés électroniques de ce composé.
Réactivité
[modifier | modifier le code]La propriété fondamentale de ce composé instable est son pouvoir d'oxydation, malgré le fait que toutes les réactions doivent être effectuées à environ −100 °C[6]. Avec le trifluorure de bore BF3 et le pentafluorure de phosphore PF5, il donne les sels de dioxygényle O+
2 correspondant[7] :
Il convertit les oxydes d'uranium et de plutonium en hexafluorure d'uranium UF6 et hexafluorure de plutonium PuF6[8].
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) A. D. Kirshenbaum et A. V. Grosse, « Ozone Fluoride or Trioxygen Difluoride, O3F2 », Journal of the American Chemical Society, vol. 81, no 6, , p. 1277 (DOI 10.1021/ja01515a003)
- (en) A. F. Holleman et E. Wiberg, Inorganic Chemistry, Academic Press, (ISBN 0-12-352651-5)
- (en) O. Ruff et W. Mensel, « Neue Sauerstofffluoride: O2F2 und OF », Zeitschrift für anorganische und allgemeine Chemie, vol. 211, nos 1–2, , p. 204–208 (DOI 10.1002/zaac.19332110122)
- (en) A. J. Bridgeman et J. Rothery, « Bonding in mixed halogen and hydrogen peroxides », Journal of the Chemical Society, Dalton Transactions, vol. 1999, no 22, , p. 4077–4082 (DOI 10.1039/a904968a)
- (en) A. G. Streng, « The Chemical Properties of Dioxygen Difluoride », Journal of the American Chemical Society, vol. 85, no 10, , p. 1380–1385 (DOI 10.1021/ja00893a004)
- (en) I. J. Solomon, « New Dioxygenyl Compounds », Inorganic Chemistry, vol. 3, no 3, , p. 457 (DOI 10.1021/ic50013a036)
- (en) D. A. Atwood, Encyclopedia of Inorganic Chemistry, John Wiley & Sons, (DOI 10.1002/0470862106.ia076), « Fluorine: Inorganic Chemistry »
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Dioxygen difluoride » (voir la liste des auteurs).
Voir aussi
[modifier | modifier le code]- (en)« Fluoride and compounds fact sheet », sur National Pollutant Inventory
- (en)« WebBook page for O2F2 », sur NIST
- (en)« Things I Won't Work With: Dioxygen Difluoride », sur sciencemag.org