Digermane
| Digermane | |||
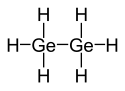
| |||
| Structure du digermane | |||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| No ECHA | 100.159.079 | ||
| PubChem | 6336261 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore | ||
| Propriétés chimiques | |||
| Formule | H6Ge2 |
||
| Masse molaire[1] | 151,33 ± 0,02 g/mol H 4 %, Ge 95,97 %, |
||
| Propriétés physiques | |||
| T° fusion | −109 °C[2] | ||
| T° ébullition | 31,5 °C[2] | ||
| Masse volumique | 1,98 g·cm-3 à −109 °C[3] | ||
| Point critique | 150,9 °C[2] | ||
| Précautions | |||
| SGH[2] | |||
| H280, H302, H312, H315, H319, H332, H335, P261, P280, P305+P351+P338 et P410+P403 |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Le digermane est un composé chimique inorganique de formule Ge2H6. C'est l'un des rares hydrures du germanium, analogue structurel du disilane Si2H6 et de l'éthane C2H6. Il se présente sous la forme d'un liquide incolore qui s'évapore à 31 °C[4] et se décompose au-dessus de 200 °C[3]. On l'obtient par réduction du dioxyde de germanium GeO2 avec du borohydrure de sodium NaBH4 : cette réaction produit essentiellement du germane GeH4, mais elle permet d'obtenir également des quantités appréciables de digermane ; des germanes supérieurs sont également produits, comme le trigermane Ge3H8[5], jusqu'à des traces de nonagermane Ge9H20. On peut également le produire par hydrolyse d'alliages magnésium-germanium.
Propriétés chimiques
[modifier | modifier le code]Les propriétés chimiques du digermane diffèrent quelque peu de celles des autres hydrures d'éléments du groupe 14 du tableau périodique, bien qu'elles présentent quelques similitudes, notamment en ce qui concerne les réactions de pyrolyse.
L'oxydation du digermane se produit à une température inférieure à celle du monogermane. Elle produit du dioxyde de germanium GeO2, qui agit à son tour comme catalyseur de la réaction, ce qui est une différence majeure d'avec les autres éléments du même groupe, car le dioxyde de carbone CO2 et le dioxyde de silicium SiO2 ne présentent pas les mêmes propriétés catalytiques[4] :
Le digermane se dismute dans l'ammoniac liquide. L'ammoniac NH3 agit comme catalyseur faiblement basique. La réaction produit de l'hydrogène H2, du germane GeH4 et un polymère solide d'hydrure de germanium[6].
On pense que la pyrolyse du digermane se déroule en plusieurs étapes :
- Ge2H6 → 2 GeH3
- GeH3 + Ge2H6 → GeH4 + Ge2H5
- Ge2H5 → GeH2 + GeH3
- GeH2 → Ge + H2
- 2 GeH2 → GeH4 + Ge
- n GeH2 → (GeH2)n.
La pyrolyse du digermane s'avère être plus endothermique que celle du disilane Si2H6. On pense que cette différence provient de la force plus grande de la liaison Ge–H par rapport à celle de la liaison Si–H. La pyrolyse du digermane peut conduire à la polymérisation de groupes GeH2 au cours de laquelle le GeH3 agit comme propagateur tandis que de l'hydrogène H2 est libéré[7].
Applications
[modifier | modifier le code]Le digermane n'a que peu d'applications pratiques, dans la mesure où l'hydrure de germanium utilisé dans l'industrie est avant tout le germane GeH4. Le digermane est de ce fait principalement utilisé comme précurseur du germanium. On peut ainsi l'utiliser pour déposer des semiconducteurs contenant du germanium par dépôt chimique en phase vapeur[8] (CVD).
La déshydrogénation de digermane sur l'or conduit à la formation de nanofils de germanium[9].
Notes et références
[modifier | modifier le code]- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Digermane 10% in hydrogen, 99.99% (excluding germane and trigermane), 9-11% (balance is hydrogen), electronic grade, consultée le 18 mars 2018.
- (en) L. M. Dennis, Robert B. Corey et Roy W. Moore, « Germanium. VII. The Hydrides of Germanium », Journal of the American Chemical Society, vol. 46, no 3, , p. 657-674 (DOI 10.1021/ja01668a015, lire en ligne)
- (en) H. J. Emeléus et E. R. Gardner, « 358. The oxidation of monogermane and digermane », Journal of the Chemical Society (Resumed), , p. 1900-1909 (DOI 10.1039/JR9380001900, lire en ligne)
- ↑ (en) William L. Jolly, John E. Drake, Ralph Rudolph et T. Wartik, « Hydrides of Germanium, Tin, Arsenic, and Antimony », Inorganic Syntheses, vol. 7, , p. 34-44 (DOI 10.1002/9780470132388.ch10, lire en ligne)
- ↑ (en) Robert M. Dreyfuss et William L. Jolly, « Disproportionation of digermane in liquid ammonia », Inorganic Chemistry, vol. 7, no 12, , p. 2645-2646 (DOI 10.1021/ic50070a037, lire en ligne)
- ↑ (en) Otto H. Johnson, « The Germanes and their Organo Derivatives », Chemical Reviews, vol. 48, no 2, , p. 259-297 (PMID 24540662, DOI 10.1021/cr60150a003, lire en ligne)
- ↑ (en) Junqi Xie, Andrew V G Chizmeshya, John Tolle, Vijay R. Dcosta, Jose Menendez et John Kouvetakis, « Synthesis, stability range, and fundamental properties of Si-Ge-Sn semiconductors grown directly on Si(100) and Ge(100) platforms », Chemistry of Materials, vol. 22, no 12, , p. 3779-3789 (DOI 10.1021/cm100915q, lire en ligne)
- ↑ (en) A. D. Gamalski, J. Tersoff, R. Sharma, C. Ducati et S. Hofmann†, « Formation of Metastable Liquid Catalyst during Subeutectic Growth of Germanium Nanowires », Nano Letters, vol. 10, no 8, , p. 2972-2976 (PMID 20608714, DOI 10.1021/nl101349e, Bibcode 2010NanoL..10.2972G, lire en ligne)



