Fluorure de fer(III)
| Fluorure de fer(III) | |
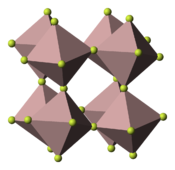
| |
| Structure du fluorure de fer(III) __ Fe3+ __ F− |
|
| Identification | |
|---|---|
| Synonymes |
fluorure ferrique |
| No CAS | |
| No ECHA | 100.029.093 |
| No CE | 232-002-4 |
| No RTECS | NO6865000 |
| PubChem | 24552 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | FeF3 |
| Masse molaire[1] | 112,84 ± 0,002 g/mol F 50,51 %, Fe 49,49 %, |
| Propriétés physiques | |
| T° fusion | 1 030 °C[2] |
| Masse volumique | 3,87 g·cm-3[2] |
| Cristallographie | |
| Système cristallin | Trigonal |
| Classe cristalline ou groupe d’espace | R3c (no 167) |
| Précautions | |
| SGH[3] | |
| H314, H302+H312+H332, P260, P280, P301+P312+P330, P303+P361+P353, P304+P340+P310 et P305+P351+P338 |
|
| Transport[3] | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le fluorure de fer(III), ou fluorure ferrique, est un composé chimique de formule FeF3, qui existe également sous forme de deux trihydrates, notés α et β, de formule FeF3·3H2O. La forme anhydre est blanche tandis que l'hydrate est rose pâle. Il s'agit d'un solide hygroscopique paramagnétique thermiquement stable contenant du fer ferrique, c'est-à-dire à l'état d'oxydation +3.
On peut préparer le fluorure de fer(III) anhydre en traitant à peu près tous les composés anhydres du fer avec du fluor F2. De façon plus pratique, on l'obtient en traitant le chlorure correspondant au fluorure d'hydrogène HF :
Il forme un film de passivation au contact du fluorure d'hydrogène avec le fer ou l'acier[4]. Les hydrates cristallisent à partir d'une solution aqueuse d'acide fluorhydrique[5].
C'est un accepteur de fluorure. Il forme le complexe [FeF4][XeF5] en présence d'hexafluorure de xénon XeF6[6].
La principale utilisation commerciale du fluorure de fer(III) est la production de céramiques. Certaines réactions de couplage sont catalysées par des composés à base de fluorure de fer(III), de même que l'addition chimiosélective de cyanure à des aldéhydes pour donner des cyanhydrines[7].
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Iron(III) fluoride » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 14 mai 2017 (JavaScript nécessaire)
- Fiche Sigma-Aldrich du composé Iron(III) fluoride, consultée le 14 mai 2017.
- (en) Jean Aigueperse, Paul Mollard, Didier Devilliers, Marius Chemla, Robert Faron, René Romano et Jean-Pierre Cuer, « Fluorine Compounds, Inorganic », Ullmann's Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.a11_307, lire en ligne)
- (en) D. G. Karraker et P. K. Smith, « α and β-ferric fluoride trihydrate revisited: crystal structure and iron-57 Moessbauer spectra », Inorganic Chemistry, vol. 31, no 6, , p. 1118-1120 (DOI 10.1021/ic00032a042, lire en ligne)
- (en) Norman N. Greenwood et Alan Earnshaw, Chemistry of the Elements, Butterworth-Heinemann 2e édition, 1997. (ISBN 0-08-037941-9).
- (en) B. P. Bandgar et V. T. Kamble, « Organic reactions in aqueous medium: FeF3 catalyzed chemoselective addition of cyanotrimethylsilane to aldehydes », Green Chemistry, vol. 3, no 5, , p. 265-266 (DOI 10.1039/B106872P, lire en ligne)





