Glucose-6-phosphatase
| N° EC | EC |
|---|---|
| N° CAS |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
La glucose-6-phosphatase est une hydrolase qui catalyse la réaction d'hydrolyse du glucose-6-phosphate en D-glucose avec libération de phosphate inorganique :
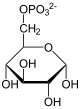 + H2O
+ H2O  + Pi.
+ Pi.
Elle est spécifique au réticulum endoplasmique
Cette enzyme intervient de façon primordiale dans plusieurs voies du métabolisme énergétique chez les vertébrés, notamment à la fin de la néoglucogenèse et de la glycogénolyse, ce qui lui confère un rôle crucial dans la régulation homéostatique de la glycémie[1]. Chez l'Homme, il en existe trois isozymes appelées G6Pase, G6Pase-2 et G6Pase-3, codées respectivement par les gènes G6PC, G6PC2 et G6PC3. On trouve ces enzymes dans le foie, les reins et, en petites quantités, dans l'intestin. La G6Pase-2 est spécifiquement localisée dans les cellules des îlots de Langerhans, dans le pancréas. L'action de la G6Pase-3 est incertaine.
Les glucose-6-phosphatases sont des protéines membranaires du réticulum endoplasmique qui forment un complexe protéique avec la glucose-6-phosphate translocase qui agit à la fois en générant l'entrée du glucose-6-phosphate dans la lumière du réticulum endoplasmique et en l'hydrolysant pour libérer le D-glucose. Ce dernier est alors transféré hors du réticulum endoplasmique par des transporteurs de glucose[2].
Notes et références
[modifier | modifier le code]- ↑ (en) Nordlie R et al., The Enzymes of biological membranes, 2nd edition, New York, Plenum Press, , 349–398 p. (ISBN 0-306-41453-8)
- ↑ (en) Abhijit Ghosh, Jeng-Jer Shieh, Chi-Jiunn Pan, Mao-Sen Sun et Janice Yang Chou, « The Catalytic Center of Glucose-6-phosphatase His176 is the nucleophile forming the phosphohistidine-enzyme intermediate during catalysis », Journal of Biological Chemistry, vol. 277, , p. 32837-32842 (lire en ligne) DOI 10.1074/jbc.M201853200


