Glucosinolate
Les glucosinolates, autrefois appelés hétérosides soufrés, ou « thioglucosides », sont des composés organiques rassemblant autour d'un atome de carbone : un glucose via une liaison par un soufre, un groupe sulfate via l'atome d'azote du groupement oxime, et une génine variable, dérivant d'un acide aminé.
Ce sont des métabolites secondaires présents dans seize familles de plantes de l'ordre des Capparales (selon la classification de Cronquist), et en particulier de la famille des Brassicaceae (les crucifères comme le chou ou le radis, appartenant à l'ordre des Brassicales selon la classification APG), qui agissent en tant que moyen de défense contre les ravageurs[1]. Leur hydrolyse libère du glucose et des composés soufrés volatile à forte odeurs piquantes. Ils sont ainsi responsables de la saveur amère ou piquante de nombreux aliments communs comme la moutarde, les radis, le cresson, le raifort, le chou-fleur etc.
Par exemple, comme glucosinolates présents chez des Brassicacées, on a le glucotropaeline dans le chou et les sinigrosides dans la moutarde noire.

Structure chimique
[modifier | modifier le code]Le squelette d'un glucosinolate comporte un glucose, un groupe sulfate et une génine variable (groupement méthyle ou de longues chaînes linéaires ou ramifiées qui contiennent des structures aromatiques ou hétérocycliques)[2]. Au début du XXIe siècle, environ 120 glucosinolates ont été identifiés dans les plantes[3]. Dans le colza (Brassica napus), on en a trouvé pas moins d'une trentaine. Cette grande diversité est liée à celle des acides aminés précurseurs de ces composés. Sept acides aminés sont concernés (alanine, leucine, isoleucine, valine, phénylalanine, tyrosine et tryptophane) et divers homologues[4]. On observe par exemple les dérivations :
- tyrosine → p-hydroxybenzylglucosinolate → sinalbine (nom formé par contraction de Sinapis alba, ancien nom latin de la moutarde blanche ou Brassica alba)
- homométhionine → allylglucosinolate → sinigroside (nom formé par contraction de Sinapis nigra, nom latin de la moutarde noire)
Fahey et collaborateurs[5] proposent une classification des glucosinolates en fonction de la structure chimique du groupe R :
- A. chaîne soufrée (Alkyle thio alkyle). C'est le groupe le plus important.
- CH3-S-(CH2)n- pour n de 2 à 11, par ex. n=3 R=3-(Méthylethio)propyle donne la glucoibervérine.
- CH3-SO-(CH2)n- pour n de 3 à 11, par ex. n=3 R=3-(Méthylesulfinyle)propyle donne la glucoibérine,
- autre ex. dans le superbrocoli "Beneforte" n=4 R=4-(Methylesulfinyle)butyle donne la glucopharanine
- CH3-SO2-(CH2)n- pour n de 3 à 10, par ex. n=3 R=3-(Méthylesulfonyle)propyle donne la glucocheiroline
- chaîne soufrée avec hydroxy- ou oxo-
- B. chaîne aliphatique linéaire, CH3(CH2)n- pour n=0 à 19, par ex. n=0 R=méthyle donne la glucocapparine, n=1 R=éthyle donne la glucolépidiine etc.
- C. chaîne aliphatique branchée, par ex. R=1-Méthyle éthyle donne la glucoputranjivine, R=1-Méthyle propyle donne la glucocochléarine etc.
- D. alcène, par ex. R=2-propényle donne la sinigrine
- E. chaîne alcoolique, par ex. R=2-Hydroxy-éthyle
- F. chaîne linéaire avec carbonyle, par ex. R=4-oxoheptile donne la glucocapanguline
- G. hydrocarbure aromatique, par ex. R=Benzyle donne la glucotropaéoline, R=4-Hydroxybenzyle donne la (gluco)sinalbine
- H. benzoate, par ex. R=2-Benzoyloxy-1-méthyléthyle donne la glucobenzosisymbrine
- I. indole, par ex. R=Indol-3-ylméthyle donne la glucobrassicine
- J. multiglycosylé et autres, par ex. R=4-(alpha-L-Rhamnopyranosyloxy)benzyle, R=3-Méthoxycarbonylpropyle donne la glucoerypestrine
| Structure du groupe radical R |
Nom systématique du radical R |
Nom trivial du glucosinolate |
|---|---|---|
| CHAINE SOUFRÉE | ||
| CH3-S-CH2-CH2-CH2- | 3-Méthylthiopropyle | Glucoibervérine |
| CHAINE ALIPHATIQUE LINÉAIRE | ||
| CH3-CH2- | Ethyl | Glucolépidiine |
| ALCÈNE | ||
| CH2=CH-CH2- | Prop-2-ényle (Allyle) | Sinigrine |
| CH2=CH-CH2-CH2- | But-3-ényle | Gluconapine |
| CH2=CH-CH2-CH2-CH2- | Pent-4-ényle | Glucobrassicanapine |
| CH2=CH-CH(OH)-CH2- | (2R)-2-Hydroxybut-3-ényle | Progoitrine |
| COMPOSÉ AROMATIQUE | ||

|
4-Hydroxybenzyle | (gluco)sinalbine |
| BENZOATE | ||

|
2-Benzoyloxy-1-méthyléthyle | Glucobenzosisymbriine |
| INDOLE | ||

|
Indol-3-ylméthyle | Glucobrassicine |
Dégradation des glucosinolates
[modifier | modifier le code]
Les glucosinolates sont stockés dans les vacuoles avec de l'acide ascorbique où ils restent non actifs tant qu'ils ne rencontrent pas une enzyme, la myrosinase. Celle-ci est localisée dans certaines cellules du phloème ou du mésophylle[4], où elle reste isolée des glucosinolates. Lorsque le tissu de la plante est lésé, la compartimentation est détruite et l'enzyme entre alors en contact avec le glucosinolate et déclenche son hydrolyse. Dans tous les cas, la génine est libérée et se réarrange en fonction du pH. L'explosion de cette "bombe à moutarde"[4] libère un grand nombre de composés très réactifs et à forte odeur :
- si le pH est neutre, il se forme un isothiocyanate, très réactif, volatil, à forte odeur et à goût amer. C'est le produit d'hydrolyse dominant pour beaucoup d'espèces.
- si le pH est acide, il se forme du nitrile.
- la formation d'un thiocyanate est également possible à pH>8, lorsque la génine du glucosinolate dérive du tryptophane. Le dit thiocyanate étant ensuite catalysé par les peroxydases afin de produire l'antimicrobien hypothiocyanite.
La nature des produits d'hydrolyse dépend de la nature chimique de la chaîne R, de la présence de réactants (ascorbates) et d'ions ferreux.
Répulsion des insectes ravageurs
[modifier | modifier le code]Les glucosinolates sont stockés dans toutes les parties de la plante et libérés lors d'une attaque de phytophages. Quand les tissus sont endommagés, les glucosinolates entrent en contact avec la myrosinase et sont hydrolysés en composés actifs, comme les Isothiocyanates, connus aussi sous le nom d'« huile de moutarde ». Beaucoup de ces produits sont toxiques pour les bactéries, champignons, nématodes et insectes. Pour les insectes, les isothiocyanates sont toxiques aussi bien en phase gazeuse, que par contact ou après ingestion.
Il a aussi été démontré que les chenilles légionnaires (Spodoptera eridania) faisaient moins de dégâts sur les pieds de moutarde brune riche en glucosinolate et myrosinase que sur ceux en contenant moins[6]. Plusieurs études ont établi que les isothiocyanates aromatiques avaient une activité insecticide sur les larves et les œufs de charançons[7].
Cependant, le principe de coévolution a permis à certains insectes de s'adapter à ce système de défenses des plantes. Ainsi la piéride de la rave (Pieris rapae) détourne l'hydrolyse du glucosinolate (grâce à une protéine PrNSP) en nitrile qui peut être rejeté dans les fèces et qui est moins toxique. Plutella xylostella désulfate les glucosinolates en métabolites qui ne peuvent plus être utilisés en substrat par la myrosinase. Le puceron du chou (Brevicoryne brassicae) détourne les défenses des plantes en stockant le composé toxique dans son hémolymphe, ce qui le rend à son tour toxique pour son prédateur Adalia bipunctata.
Toxicité des glucosinolates dans la nutrition humaine et animale
[modifier | modifier le code]En excès, certains glucosinolates sont toxiques, notamment ceux des choux qui les synthétisent pour se défendre contre les herbivores. Les hommes ont dû commencer à consommer ce produit sous forme de choucroute : les bactéries (Leuconostoc, Lactobacillus spp) qui se développent au cours de la fermentation, dégradent les cellules végétales, relâchant ces molécules soufrées, si bien que la toxicité s'échappe avant consommation. La cuisson des aliments réduit l’activité de la myrosinase, diminuant la possibilité de transformer les glucosinolates en composés actifs toxiques. Les formes de choux actuels ont progressivement été sélectionnées pour être moins riches en glucosinolates, et sont à présent consommables crues[8].
Il a été observé que lorsque des moutons, des lapins ou des bovins absorbaient de grandes quantités de choux ou de colza, ils développaient un hypofonctionnement de la glande thyroïde entraînant goitre, avortements et mort des fœtus[2]. Les produits de dégradation des glucosinolates contenus dans ces plantes sont responsables d'une hypertrophie de la thyroïde, du foie et des reins et d'une élévation du taux de mortalité. Les effets délétères sont plus importants chez les non-ruminants que chez les ruminants et chez les jeunes que chez les adultes. La raison en est que les ions thiocyanates[9] et les ions iodures partagent un certain nombre de propriétés physicochimiques et sont donc en compétition pour leur capture, leur oxydation etc[10].
Une ingestion importante de glucosinolates par les poules accroît leur mortalité et diminue leur production d'œufs, alors qu'elle peut être fatale pour les cochons[11]. Les ruminants sont comparativement plus tolérants à l'ingestion de glucosinolates parce que leur microflore intestinale transforme ces composés et leurs métabolites. Toutefois, des rations alimentaires à forte teneur en glucosinolates ralentissent la croissance des veaux[11].
Lorsque des souris gestantes absorbent dans leur boisson des thiocyanates, on observe chez les souriceaux après le sevrage, une diminution du poids corporel (10 %), du contenu en iode (40 %) et des taux plasmatiques d'hormones thyroïdiennes FT4 et FT3 (18 %)[12].
En Amérique du Nord comme en France, la qualité des colzas s'est beaucoup améliorée ces dernières décennies, avec la sélection de colza « double zéro » 00, à très basse teneur en glucosinolates et dépourvu d'acide érucique. Le colza 00 canadien, qui est en fait une navette pauvre en glucosinolates, a été baptisé « canola ». Aujourd'hui les tourteaux de colza disponibles peuvent être consommés par les vaches laitières sans risque pour leur santé.
Effets bioprotecteurs des glucosinolates
[modifier | modifier le code]À forte dose dans l'alimentation, les glucosinolates sont toxiques et antinutritifs mais à faibles doses, en dessous des seuils de toxicité, leurs produits de dégradation ont des propriétés antifongiques, antibactériennes, anti-oxydantes, antimutagéniques et anticarcinogéniques, toutes bénéfiques.
De nombreuses études se sont intéressées au potentiel bioprotecteur des produits d'hydrolyse des glucosinolates à savoir les isothiocyanates, les nitriles et les thiocyanates. L'enzyme responsable de cette dégradation, la myrosinase, est présente dans la plante mais on la trouve aussi dans la microflore intestinale.
Diverses études[13] ont montré que les résidus de brocoli étendus sur des sols contaminés par un champignon responsable du flétrissement verticillien (Verticillium dahliae), permettait de diviser par 5 les microsclérotes.
Activités antibactériennes
[modifier | modifier le code]L'isothiocyanate d'allyle (ou allylsénévol) a une bonne activité antibactérienne qui est utilisée à des fins de conservation des aliments. Les viticulteurs italiens s'en servent pour créer une atmosphère stérile dans les cuves de moût en fermentation[14], mais ce composé ayant des notes piquantes de moutarde, aucune trace ne doit être présente dans le vin.
Le sulforaphane, un isothiocyanate commun, est capable d’inactiver une bactérie redoutable, Helicobacter pylori. En effet, lorsque celle-ci infecte sur le long terme l’estomac, elle accroit le risque de cancer gastrique. Il a été montré que l’administration de 7,5 μmol/ml de sulforaphane à des souris portant une xénogreffe gastrique humaine est capable d’éradiquer en 5 jours H. pylori[15]. Yanaka et coll. ont montré en 2009, que la consommation de germes de brocoli permettait de réduire significativement l’infection par H. pylori chez les humains. L’équipe a donné à 48 Japonais infectés par la bactérie, 70 grammes de germes de brocoli pendant 8 semaines et l’équivalent en germes de luzerne comme placebo aux témoins et constaté une baisse significative des biomarqueurs de l’infection chez les consommateurs de brocoli et pas chez le groupe témoin[16].
| Isothiocyanates | Formules | Le glucosinolate précurseur | Sources alimentaires |
|---|---|---|---|
| ISOTHIOCYANATES | |||
| Sulforaphane | 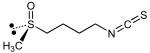 |
Glucoraphanine R=4-(Méthylsulfinyle)butyle |
Brocoli, choux de Bruxelles, choux-fleurs |
| Isothiocyanate de phénéthyle |  |
Gluconasturtiine R=2-Phényléthyle |
Cresson (Nasturtium officinale), racine de raifort (Armoracia rustica) |
| Isothiocyanate de benzyle | Glucotropaeoline R=Benzyle |
Choux, cresson alénois (Lepidum sativum), capucine (Tropaeolum) | |
| Isothiocyanate d'allyle | 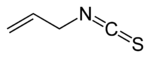 |
Sinigrine R=2-Propényle |
Choux, racine de raifort (Armoracia rustica), moutarde, wasabi |
| INDOLE | |||
| Indole-3-carbinol |  |
Glucobrassicine | Brocoli, choux-fleur |
Activité anticarcinogène
[modifier | modifier le code]Plusieurs études épidémiologiques de cohortes[17] suggèrent qu'une alimentation riche en crucifères pourrait protéger contre les risques du cancer du poumon et du cancer colorectal. Mais quelques autres études du même genre n'ayant pas retrouvé cette association, on pense actuellement que l'effet de la consommation de crucifères pourrait être influencée par une capacité individuelle différente, d'origine génétique, à éliminer plus ou moins rapidement les produits d'hydrolyse des glucosinolates[18]. En ce qui concerne le cancer de la prostate, Higdon et coll[18]. (2007) concluent qu'« actuellement, les études épidémiologiques corroborent faiblement l'hypothèse qu'une prise importante de crucifères diminue le risque de cancer de la prostate ».
Les études en cancérologie animale soutiennent, elles clairement, l'hypothèse que la consommation de crucifères joue un rôle protecteur à l'encontre des substances cancérigènes. Elles montrent qu'à forte dose, les isothiocyanates et les indoles induisent des enzymes de "phase II" qui détoxifient les métabolites électrophiles susceptibles d'altérer la structure de l'ADN[2].
Références
[modifier | modifier le code]- ↑ Adjélé Eli Wilson, Recherche d'isothiocyanates à intérêts fonctionnel et technologique chez les Brassicacées, thèse 2011, p. 16
- Bruneton, J., Pharmacognosie - Phytochimie, plantes médicinales, 4e éd., revue et augmentée, Paris, Tec & Doc - Éditions médicales internationales, , 1288 p. (ISBN 978-2-7430-1188-8)
- ↑ (en) Barbara Ann Halkier & Jonathan Gershenzon, « Biology and biochemistry of glucosinolates », Annual Review of Plant Biology, vol. 57, , p. 303-333 (DOI 10.1146/annurev.arplant.57.032905.105228).
- (en) Sixue Chen, Erik Andreasson, « Update on glucosinolate metabolism and transport », Plant Physiol. Biochem., vol. 39,
- ↑ (en) Jed W. Fahey, Amy T. Zalcmann, Paul Talalay, « The chemical diversity and distribution of glucosinolates and isothiocyanates among plants », Phytochemistry, vol. 56, , p. 5-51
- ↑ (en) Ute Wittstock, Daniel J. Kliebenstein, Virginia Lambrix, Michael Reichelt, and Jonathan Gershenzon, « GLUCOSINOLATE HYDROLYSIS AND ITS IMPACT ON GENERALIST AND SPECIALIST INSECT HERBIVORES », in Integrative phytochemistry : from ethnobotany to molecular ecology, Wittstock et al. Elsevier,
- ↑ (en) Adarsh Pal Vig, Geetanjali Rampal, Tarunpreet Singh Thind, Saroj Arora, « Bio-protective effects of glucosinolates - A review », Food science and technology, vol. 42, , p. 1561-1572
- ↑ Marc-André Selosse, Jamais seul. Ces microbes qui construisent les plantes, les animaux et les civilisations, Éditions Actes Sud, , p. 121
- ↑ un thiocyanate est formée par la chaine d'atomes R-S-C≡N
- ↑ Signalons d'ailleurs, que les fumeurs sont aussi contaminés par les thiocyanates en raison de la présence de cyanure d'hydrogène H-C≡N dans la fumée de cigarette, qui est détoxifié en thiocyanate
- (en) M.K.Tripathi, A.S.Mishra, « Glucosinolates in animal nutrition: A review », AnimalFeed Science and Technology, vol. 132, , p. 1-27
- ↑ (en) Hela Ghorbel, Hamadi Fetoui, Amira Mahjoubi, Fadhel Guermazi, Najiba Zeghal, « Thiocyanate effects on thyroid function of weaned mice », C.R. Biologie, vol. 331, , p. 262-271
- ↑ (en) Koike S., Subbarao K.V., « Broccoli residues can control Verticillium wilt of cauliflower », California Agriculture, vol. 4,
- ↑ Europa
- ↑ (en) X. Haristoy, K. Angioi-Duprez, A. Duprez, A. Lozniewski,, « Efficacy of sulforaphane in eradicating Helicobacter pylori in human gastric xenografts implanted in nude mice », Antimicrob. Agents Chemother., vol. 47, , p. 3982-3984
- ↑ (en) Yanaka A, Fahey JW, Fukumoto A, Nakayama M, Inoue S, Zhang S, Tauchi M, Suzuki H, Hyodo I, Yamamoto M., « Dietary sulforaphane-rich broccoli sprouts reduce colonization and attenuate gastritis in Helicobacter pylori-infected mice and humans. », Cancer Prev Res (Phila Pa), vol. 2, no 4,
- ↑ observation d'un groupe de personnes exposées à un facteur de risque pendant une période donnée et comparaison à un groupe contrôle non exposé
- (en) Jane V. Higdon, Barbara Delage, David E. Williams, Roderick H. Dashwood, « Cruciferous vegetables and human cancer risk : epidemiologic evidence and mechanistic basis », Pharmacological Research, vol. 55, , p. 224-236


