Hydroxyde de strontium
| Hydroxyde de strontium | |
| |
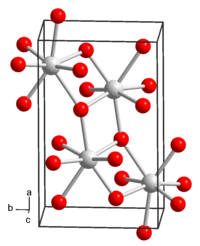
| __ Sr2+ __ OH− Structure cristalline de l'hydroxyde de strontium |
|
| Identification | |
|---|---|
| No CAS | (anhydre) (octahydrate) (monohydrate) |
| No ECHA | 100.038.501 |
| No CE | 242-367-1 |
| No RTECS | WK9100000 |
| PubChem | 87672 |
| ChEBI | 35105 |
| SMILES | |
| InChI | |
| Apparence | Poudre blanche cristallisée[1] |
| Propriétés chimiques | |
| Formule | Sr(OH)2 |
| Masse molaire[2] | 121,63 ± 0,01 g/mol H 1,66 %, O 26,31 %, Sr 72,04 %, |
| Propriétés physiques | |
| T° fusion | 100 °C[1] (octahydrate) |
| Solubilité | 20 g·L-1[1] |
| Masse volumique | 3,63 g·cm-3[1] à 20 °C (anhydre) 1,90 g·cm-3[1] à 25 °C (octahydrate) |
| Précautions | |
| SGH[1] | |
| H314, EUH071, P260, P280, P303+P361+P353 et P305+P351+P338 |
|
| Transport[1] | |
| Composés apparentés | |
| Autres cations | Hydroxyde de béryllium Hydroxyde de magnésium Hydroxyde de calcium Hydroxyde de baryum |
| Autres anions | Oxyde de strontium Peroxyde de strontium |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'hydroxyde de strontium est un composé chimique de formule Sr(OH)2. Il s'agit d'un sel cristallisé incolore dans lequel chaque cation de strontium Sr2+ est entouré par sept anions hydroxyde OH− à une distance moyenne de 260 pm. Dissous dans l'eau, c'est une base moyennement forte qui tend à réagir avec le dioxyde de carbone CO2 dissous pour former du carbonate de strontium SrCO3. L'hydroxyde de strontium est plus soluble dans l'eau que l'hydroxyde de calcium Ca(OH)2 et l'hydroxyde de magnésium Mg(OH)2. Il est moins toxique que l'hydroxyde de baryum Ba(OH)2.
L'octahydrate cristallise dans le système cristallin tétragonal et le groupe d'espace P4/ncc (no 130) avec comme paramètres cristallins a = 901,7 pm et c = 1 160,3 pm[3]. Par chauffage, l'octahydrate Sr(OH)2·8H2O libère son eau de cristallisation en formant un hexahydrate Sr(OH)2·6H2O, puis un monohydrate Sr(OH)2·H2O, et enfin le composé anhydre Sr(OH)2, qui cristallise également dans le système réticulaire tétragonal[3].
L'hydroxyde de strontium peut être obtenu en faisant réagir du strontium Sr avec de l'eau H2O, ce qui donne de l'hydroxyde de strontium Sr(OH)2 et de l'hydrogène H2 :
Il se forme également par réaction de l'oxyde de strontium SrO avec l'eau, réaction accompagnée d'un fort dégagement de chaleur :
En raison de sa faible solubilité, l'octahydrate peut être préparé à partir de n'importe quel sel de strontium, de préférence à partir du nitrate de strontium Sr(NO3)2 ou du chlorure de strontium SrCl2 en raison de leur solubilité élevée, par addition d'une base forte comme l'hydroxyde de sodium NaOH ou l'hydroxyde de potassium KOH dans une solution aqueuse :
L'octahydrate de strontium précipite sous forme d'une poudre blanche, qu'il est ensuite possible de filtrer, laver et sécher pour obtenir le produit pur[4].
L'hydroxyde de strontium est principalement utilisé dans le raffinage du sucre de betterave pour nettoyer la mélasse et comme additif dans les plastiques. Il peut être utilisé comme source d'ions strontium lorsque le chlore du chlorure de strontium SrCl2 est indésirable.
Notes et références
[modifier | modifier le code]- Entrée « Strontium hydroxide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 24 avril 2019 (JavaScript nécessaire)
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Richard C. Ropp, Encyclopedia of the Alkaline Earth Compounds, Newnes, 2012, p. 122. (ISBN 0-444-59553-8)
- ↑ (en) Georg Brauer, Handbook Of Preparative Inorganic Chemistry, Academic Press, 1963, p. 935.

