Intoxication au toluène
Le toluène, également appelé méthylbenzène ou phénylméthane est un hydrocarbure aromatique sous la forme d'un liquide transparent, très répandu et utilisé comme produit de départ industriel ou comme solvant. Sa manipulation comporte des risques pour la santé de l’utilisateur. Les troubles provoqués chez les travailleurs sont d’ailleurs reconnus au titre de la maladie professionnelle.
| Toxicologie | |
|---|---|
| |
| Toluène | |
| Numéro CAS | 108-88-3 |
| Formule chimique | C7H8 |
| Masse moléculaire | 92.14052 |
| Biodisponibilité | |
| Métabolisme | |
| Demi-vie d’élimination | |
| Excrétion | Poumons |
| Voies d’exposition | Peau, Poumons |
| hydrocarbure aromatique | |
Métabolisme chez l’homme
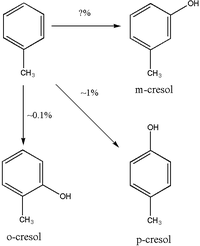
[modifier | modifier le code]Même si une importante quantité du toluène, 25 % à 40 %, est expirée sous forme inchangée par les poumons, la plus grande partie est métabolisée et excrétée par d'autres voies d’élimination. La principale voie du métabolisme du toluène est celle de l’hydroxylation en alcool benzylique par la chaîne des enzymes de la famille du cytochrome p450 (CYP)[1]. Il existe cinq CYP qui ont un rôle important dans le métabolisme du toluène, CYP1A2, CYP2B6, CYP2E1, CYP2C8 et CYP1A1[2]. Les quatre premiers semblent être impliqués dans l'hydroxylation du toluène en alcool benzylique. La CYP2El semble être la principale enzyme intervenant dans l'hydroxylation du toluène, représentant environ 44 % du métabolisme du toluène[1] cependant, il existe une grande variabilité ethnique, dans la population finlandaise, par exemple la principale enzyme est la CYP2B6. La CYP2E1 catalyse la formation d'alcool benzylique et de p-crésol[1],[2] alors que la CYP2B6 produit comparativement peu de p-cresol[2].
On estime que chez l'homme, l'alcool benzylique est métabolisé en benzaldéhyde par la CYP plutôt que par l’alcool déshydrogénase[3]. Toutefois, cette conviction ne semble pas être universelle[4],[5]. La benzaldéhyde est métabolisée, à son tour, en acide benzoïque, principalement par l’aldéhyde déshydrogénase-2 mitochondriale (ALDH-2), alors que seul un petit pourcentage est métabolisé par l’ALDH-1[5].
L'acide benzoïque est métabolisé soit en glucuronide de benzoyle ou en acide hippurique[4],[6]. Le glucuronide de benzoyle est produit par la réaction de l'acide benzoïque avec l'acide glucuronique (glycuroconjuguaison), qui représente 10-20 % de l’élimination de l'acide benzoïque. L’acide hippurique est également connu comme étant une benzoylglycine et est produit à partir de l'acide benzoïque en deux étapes : d'abord l'acide benzoïque est transformé en benzoyl-CoA par l'enzyme benzoyle-CoA synthétase, puis le benzoyl-CoA est transformé en acide hippurique par la benzoyl-CoA: glycine N -Acyltransférase[7]. L’acide hippurique est le principal métabolite urinaire du toluène[4].
L’hydroxylation en crésols est une voie mineure dans le métabolisme du toluène. La majorité des crésols sont éliminés sous forme inchangée dans l'urine, mais une partie du p-crésol et du o-crésol est excrétée sous forme de conjugués. Les études chez le rat ont montré que le p-crésol est principalement conjugué avec l’acide glucuronique pour produire des p-cresylglucuronides, mais cela n’est peut être pas applicable à l'homme[8]. L’o-crésol semble être essentiellement excrété dans les urines sous forme inchangée ou que sous forme de glycuro ou sulfo conjugué[9]. Il semble y avoir des différends sur la question de savoir si le m-crésol est, ou non, un produit du métabolisme du toluène[4],[10].
Influences de l’environnement
[modifier | modifier le code]Lorsque survient une exposition au toluène, il existe généralement une exposition simultanée à plusieurs autres produits chimiques[4]. Souvent, l'exposition au toluène est concomitante avec une exposition au benzène et, comme les deux substances sont dans une certaine mesure, métabolisées par les mêmes enzymes, le rapport de leurs concentrations relatives permettra de déterminer leur taux d'élimination[4]. Bien sûr, plus le toluène est long à éliminer, plus il est susceptible d’avoir des effets nocifs.
La consommation en tabac et alcool des personnes exposées au toluène, détermine en partie l'élimination du toxique. Des études ont montré que même une consommation aigüe modeste d'éthanol pouvait réduire de manière significative la diffusion ou l'élimination du toluène dans le sang en accroissant l’exposition des tissus[11]. D'autres études ont montré que la consommation chronique d'éthanol pouvait accélérer le métabolisme du toluène par induction de la CYP2E1[12]. Il a été montré que le tabagisme pouvait augmenter le taux d'élimination du toluène, peut-être à cause d’une induction enzymatique[13].
Le régime alimentaire peut également influer sur l'élimination du toluène. Une alimentation pauvre en hydrates de carbone et le jeûne ont tous les deux été présentés comme capables de provoquer l’induction de la CYP2E1 et, par conséquent, d’augmenter le métabolisme du toluène[12]. Un régime alimentaire faible en protéines peut entrainer une diminution du contenu en CYP totale et ainsi réduire le taux d'élimination du médicament[12].
Mesure de l’exposition
[modifier | modifier le code]L’acide hippurique a longtemps été utilisé comme indicateur d'exposition au toluène[14].Cependant, il semble exister un doute sur sa validité[15]. Il existe une importante production endogène d'acide hippurique chez l'homme, avec des variations inter-et intra-individuelles influencées par des facteurs tels que l'alimentation, les traitements médicamenteux, la consommation d'alcool, etc[15]. Cela donne à penser que l’acide hippurique pourrait être un indicateur d'exposition au toluène peu fiable[15],[16]. Il a été suggéré que l'acide hippurique urinaire, marqueur traditionnel d’exposition au toluène n'était tout simplement pas assez sensible pour différencier les personnes exposées des non-exposées[17]. Cela a conduit à étudier d'autres métabolites comme marqueurs d'exposition au toluène.
L’o-crésol urinaire pourrait être plus fiable pour la biosurveillance de l'exposition au toluène parce que, à la différence de l’acide hippurique, l’o-crésol n'est pas retrouvé à des niveaux détectables chez les sujets non exposés[16]. L’o-Crésol pourrait être un marqueur moins sensible de l'exposition au toluène que l’acide hippurique[18].L’excrétion de l’o-Crésol pourrait être une méthode fiable pour mesurer l'exposition au toluène puisque l’o-crésol représente moins de 1 % du total de l’élimination du toluène[14].
L’acide benzylmercapturic, un métabolite mineur du toluène, est produit à partir de la benzaldéhyde[19]. Au cours des dernières années, des études ont suggéré d'utiliser l’acide benzylmercapturic urinaire comme marqueur preferentiel de l'exposition au toluène, parce qu’il n'est pas détecté dans les sujets non-exposés, qu’il est plus sensible que l’acide hippurique à de faibles concentrations, qu’il n'est pas affecté par l’alimentation ou la boisson, qu’il peut détecter une exposition au toluène à un niveau d’environ 15 ppm, et qu’il montre une meilleure relation dose effet avec l’exposition au toluène que l’acide hippurique ou l’o-crésol[20],[21].
Effets de l’exposition à long terme
[modifier | modifier le code]De graves effets négatifs sur le comportement sont souvent associés à une exposition excessive au toluène liée à l'inhalation délibérée de solvants[22]. l'exposition au toluène à long terme est souvent associée à des manifestations telles que le syndrome psychoorganique[23]des anomalies des potentiels évoqués visuels (PEV)[23], des polyneuropathies toxiques, des atteintes cérébelleuses, cognitives et des pyramidales[22],[23],une atrophie optique et des lesions cérébrales[22].
Le toluène provoque des tremblements posturaux par une augmentation des concentrations extracellulaires d’acide gamma-aminobutyrique (GABA) dans le cortex cérébelleux[22]. Le traitement par les agonistes du GABA tels que, les benzodiazépines procurent une certaine atténuation des tremblements induits par le toluène, ainsi que de l’ataxie[22]. Une alternative au traitement médicamenteux est la thalamotomie[22]. Les tremblements associés à l’abus de toluène ne semblent pas être un symptôme transitoire, mais on observe une évolution irréversible et progressive des symptômes qui continue après la cessation de l’intoxication aux solvants[22].
Il existe certaines preuves qu’un faible niveau d'exposition au toluène peut provoquer des perturbations dans la différenciation des cellules précurseurs des astrocytes[24]. Cela ne semble pas être un risque majeur pour les adultes, mais l'exposition au toluène des femmes enceintes pendant les phases critiques du développement fœtal peut provoquer des troubles graves du développement neuronal[24].
Notes et références
[modifier | modifier le code]- (en) M Shou, T. Lu, KW Krausz, Y. Sai, T. Yang, KR Korzekwa, FJ Gonzalez et HV Gelboin, « Use of inhibitory monoclonal antibodies to assess the contribution of cytochromes P450 to human drug metabolism », European Journal of Pharmacology, vol. 394, nos 2-3, , p. 199–209 (PMID 10771285, DOI 10.1016/S0014-2999(00)00079-0).
- (en) T Nakajima, RS Wang, E. Elovaara, FJ Gonzalez, HV Gelboin, H. Raunio, O. Pelkonen, H. Vainio et T. Aoyama, « Toluene metabolism by cDNA-expressed human hepatic cytochrome P450 », Biochemical Pharmacology, vol. 53, no 3, , p. 271–7 (PMID 9065730, DOI 10.1016/S0006-2952(96)00652-1).
- (en) DE Chapman, TJ Moore, SR Michener et G. Powis, « Metabolism and covalent binding of [14C]toluene by human and rat liver microsomal fractions and liver slices », Drug Metabolism and Disposition, vol. 18, no 6, , p. 929–36 (PMID 1981539).
- (en) Agency for Toxic Substances and Disease Registry, Toxicological profile for toluene, Atlanta, GA, Agency for Toxic Substances and Disease Registry, (OCLC 47129207, lire en ligne).
- (en) T. Kawamoto, K. Matsuno, Y. Kodama, K. Murata et S. Matsuda, « ALDH2 polymorphism and biological monitoring of toluene », Archives of Environmental Health, vol. 49, no 5, , p. 332–6 (PMID 7944563).
- (en) Organisation mondiale de la santé, Environmental Health Criteria No. 52 (Toluene), Genève, World Health Organization, (ISBN 92-4-154192-X, lire en ligne).
- (en) Z. Gregus, T. Fekete, E. Halászi et C.D. Klaassen, « Lipoic acid impairs glycine conjugation of benzoic acid and renal excretion of benzoylglycine », Drug Metabolism and Disposition, vol. 24, no 6, , p. 682–8 (PMID 8781786).
- (en) G Lesaffer, R De Smet, T D'Heuvaert, FM Belpaire, N Lameire et R Vanholder, « Comparative kinetics of the uremic toxin p-cresol versus creatinine in rats with and without renal failure », Kidney International, vol. 64, no 4, , p. 1365–73 (PMID 12969155, DOI 10.1046/j.1523-1755.2003.00228.x)
- (en) L Wilkins-Haug, « Teratogen update: toluene », Teratology, vol. 55, no 2, , p. 145–51 (PMID 9143096, DOI 10.1002/(SICI)1096-9926(199702)55:2<145::AID-TERA5>3.0.CO;2-2)
- (en) W Tassaneeyakul, DJ Birkett, Edwards, ME Veronese, W Tassaneeyakul, RH Tukey et JO Miners, « Human cytochrome P450 isoform specificity in the regioselective metabolism of toluene and o-, m- and p-xylene », J. Pharmacol. Exp. Ther., vol. 276, no 1, , p. 101–8 (PMID 8558417)
- (en) M Wallen, PH Näslund et MB Nordqvist, « The effects of ethanol on the kinetics of toluene in man », Toxicology and Applied Pharmacology, vol. 76, no 3, , p. 414–9 (PMID 6506069)
- (en) T Nakajima, RS Wang et N Murayama, « Immunochemical assessment of the influence of nutritional, physiological and environmental factors on the metabolism of toluene », International Archives of Occupational and Environmental Health, vol. 65, no 1 Supplement, , S127–30 (PMID 8406908, DOI 10.1007/BF00381323)
- (en) EW Hjelm, PH Näslund et M Wallén, « Influence of cigarette smoking on the toxicokinetics of toluene in humans », Journal of Toxicology and Environmental Health, vol. 25, no 2, , p. 155–63 (PMID 3172270)
- (en) Y Duydu, S Süzen, N Erdem, H Uysal et N Vural, « Validation of hippuric acid as a biomarker of toluene exposure », Bulletin of Environmental Contamination and Toxicology, vol. 63, no 1, , p. 1–8 (PMID 10423476, DOI 10.1007/s001289900940)
- (en) J Angerer, « Occupational chronic exposure to organic solvents. XII. O-cresol excretion after toluene exposure », International Archive of Occupational and Environmental Health, vol. 56, no 4, , p. 323–8 (PMID 4066055, DOI 10.1007/BF00405273)
- (en) J Angerer, « Occupational chronic exposure to organic solvents. XVI. Ambient and biological monitoring of workers exposed to toluene », International Archives of Occupational and Environmental Health, vol. 69, no 2, , p. 91–6 (PMID 9001914, DOI 10.1007/s004200050121)
- (en) O Inoue, « Effects of smoking and drinking on excretion of hippuric acid among toluene-exposed workers », International Archives of Occupational and Environmental Health, vol. 64, no 6, , p. 425–30 (PMID 8458658, DOI 10.1007/BF00517948)
- (en) O Inoue, « Effects of smoking and drinking habits on urinary o-cresol excretion after occupational exposure to toluene vapor among Chinese workers », American Journal of Industrial Medicine, vol. 25, no 5, , p. 697–708 (PMID 8030640)
- (en) S Laham, « Biological conversion of benzaldehyde to benzylmercapturic acid in the Sprague-Dawley rat », Drug and Chemical Toxicology, vol. 10, nos 3-4, , p. 209–25 (PMID 3428183)
- (en) O Inoue, « Benzylmercapturic acid is superior to hippuric acid and o-cresol as a urinary marker of occupational exposure to toluene », Toxicology Letters, vol. 147, no 2, , p. 177–86 (PMID 14757321, DOI 10.1016/j.toxlet.2003.11.003)
- (en) O Inoue, « Urinary benzylmercapturic acid as a marker of occupational exposure to toluene », International Archives of Occupational and Environmental Health, vol. 75, no 5, , p. 341–7 (PMID 11981673, DOI 10.1007/s00420-002-0322-8)
- (en) Y. Miyagi, F. Shima, K. Ishido, T. Yasutake et K. Kamikaseda, « Tremor induced by toluene misuse successfully treated by a Vim thalamotomy », Journal of Neurology Neurosurgery and Psychiatry, vol. 66, no 6, , p. 794–796 (PMID 10329759, lire en ligne)
- (en) P Urban, « Neurological and neurophysiological follow-up on workers with severe chronic exposure to toluene », Neurotoxicity, vol. P25, no s130,
- (en) H Yamaguchi, « Toluene at environmentally relevant low levels disrupts differentiation of astrocyte precursor cells », Archives of Environmental Health, vol. 57, no 3, , p. 232–8 (PMID 12507177)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Toluene (toxicology) » (voir la liste des auteurs).
Lien externe
[modifier | modifier le code]- (en) ATSDR - Case Studies in Environmental Medicine: Toluene Toxicity U.S. Department of Health and Human Services (public domain)