Longifolène
| Longifolène | |

| |
| Identification | |
|---|---|
| Nom UICPA | (1R,2S,7S,9S)-3,3,7-triméthyl-8-méthylènetricyclo-[5.4.0.02,9]undécane |
| No CAS | (+) : (-) : |
| No ECHA | 100.006.812 |
| PubChem | (+) : 1796220, (-) : 1201520 |
| Propriétés chimiques | |
| Formule | C15H24 [Isomères] |
| Masse molaire[1] | 204,351 1 ± 0,013 7 g/mol C 88,16 %, H 11,84 %, |
| Propriétés physiques | |
| Masse volumique | 0,928 g·cm-3 |
| Propriétés optiques | |
| Pouvoir rotatoire | ± 42.73° |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le longifolène est un composé chimique, un hydrocarbure huileux présent notamment dans la résine de certains pins. Il tire d'ailleurs son nom de l'espèce à partir de laquelle il a été isolé[2], Pinus longifolia (devenue Pinus roxburghii)[3].
Chimiquement, le longifolène est un sesquiterpène tricyclique qui possède deux énantiomères. Sa structure a été déterminée au début des années 1950. Le longifolène est utilisé en synthèse organique pour la préparation du dilongifolylborane, un agent hydroborant chiral[4].
Le (+)-longifolène se trouve en quantité appréciable dans diverses espèces de résineux et certaines autres plantes, le (-)-longifolène est présent en plus faibles quantités chez certains champignons et hépatiques.
Le thé Lapsang souchong contient du longifolène parce qu'il est fumé au bois de résineux[5], c'est ainsi l'un des deux arômes les plus abondants de ce thé.
Synthèse totale
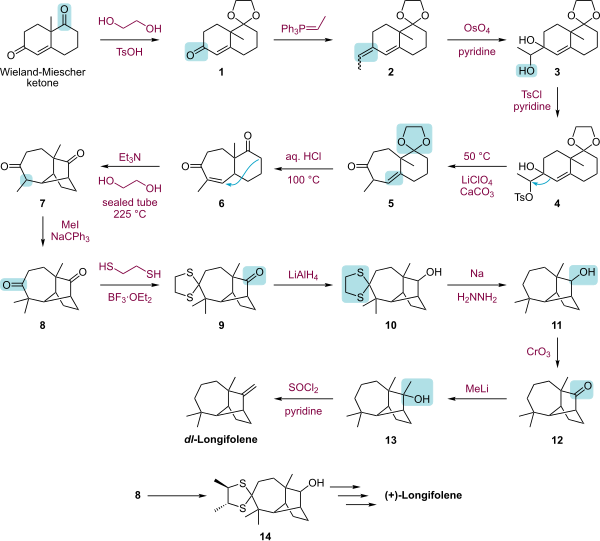
[modifier | modifier le code]En raison de sa chiralité, de sa structure tricyclique compacte et de l'absence de groupes fonctionnels, le longifolène est une cible intéressante pour les groupes de recherche souhaitant explorer de nouvelles stratégies de synthèse. Parmi les synthèses notables, on compte celles de Corey[6],[7] en 1961, de McMurry[8] en 1972, de Johnson[9] en 1975, d'Oppolzer[10] en 1978, ou de Schultz[11] en 1985. Fallis a également publié[12] en 1990 une synthèse stéréosélective du (+)-longifolène en utilisant une réaction de Diels-Alder intramoléculaire.
Biosynthèse
[modifier | modifier le code]Le longifolène est synthétisé, comme tous les sesquiterpènes, à partir du farnésyl-pyrophosphate (1), qui subit une polycyclisation cationique en cascade. La perte du groupe pyrophosphate et la cyclisation sur la liaison π distale donne l'intermédiaire cationique (3), qui subit une transposition sigmatropique résultant en l'intermédiaire (4). De là, les deux doubles liaisons restantes donnent deux cyclisations supplémentaires, aboutissant à l'intermédiaire (6). Le longifolène résulte d'un réarrangement 1,2 de ce cation intermédiaire. Sans ce réarrangement, le cation (6) (longifolenyl) peut aboutir, par une nouvelle cyclisation, à du longicyclène[13].

Références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Naffa, P.; Ourisson, G. Bulletin de la Société chimique de France, 1954, 1410.
- Simonsen, J. L. J. Chem. Soc. 1920, 117, 570.
- Jadhav, P. K.; Brown, H. C. J. Org. Chem. 1981, 46, 2988.
- Shan-Shan Yao, Wen-Fei Guo, Yi Lu et Yuan-Xun Jiang, « Flavor Characteristics of Lapsang Souchong and Smoked Lapsang Souchong, a Special Chinese Black Tea with Pine Smoking Process », Journal of Agricultural and Food Chemistry, vol. 53, no 22, , p. 8688–8693 (ISSN 0021-8561, DOI 10.1021/jf058059i, lire en ligne, consulté le )
- E. J. Corey, Masaji Ohno, Paul A. Vatakencherry et Rajat B. Mitra, « TOTAL SYNTHESIS OF d,l-LONGIFOLENE », Journal of the American Chemical Society, vol. 83, no 5, , p. 1251–1253 (ISSN 0002-7863, DOI 10.1021/ja01466a056, lire en ligne, consulté le )
- E. J. Corey, Masaji. Ohno, Rajat B. Mitra et Paul A. Vatakencherry, « Total Synthesis of Longifolene », Journal of the American Chemical Society, vol. 86, no 3, , p. 478–485 (ISSN 0002-7863, DOI 10.1021/ja01057a039, lire en ligne, consulté le )
- John E. McMurry et Stephen J. Isser, « Total synthesis of longifolene », Journal of the American Chemical Society, vol. 94, no 20, , p. 7132–7137 (ISSN 0002-7863, DOI 10.1021/ja00775a044, lire en ligne, consulté le )
- Robert A. Volkmann, Glenn C. Andrews et William S. Johnson, « Novel synthesis of longifolene », Journal of the American Chemical Society, vol. 97, no 16, , p. 4777–4779 (ISSN 0002-7863, DOI 10.1021/ja00849a062, lire en ligne, consulté le )
- Wolfgang Oppolzer et Thierry Godel, « A new and efficient total synthesis of (.+-.)-longifolene », Journal of the American Chemical Society, vol. 100, no 8, , p. 2583–2584 (ISSN 0002-7863, DOI 10.1021/ja00476a071, lire en ligne, consulté le )
- Arthur G. Schultz et Salvador Puig, « The intramolecular diene-carbene cycloaddition equivalence and an enantioselective Birch reduction-alkylation by the chiral auxiliary approach. Total synthesis of (.+-.)- and (-)-longifolene », The Journal of Organic Chemistry, vol. 50, no 6, , p. 915–916 (ISSN 0022-3263, DOI 10.1021/jo00206a049, lire en ligne, consulté le )
- Lei Bo et Alex G. Fallis, « Direct total synthesis of (+)-longifolene via an intramolecular Diels-Alder strategy », Journal of the American Chemical Society, vol. 112, no 11, , p. 4609–4610 (ISSN 0002-7863, DOI 10.1021/ja00167a105, lire en ligne, consulté le )
- (en) Sunil Kumar Talapatra et Bani Talapatra, Chemistry of plant natural products : stereochemistry, conformation, synthesis, biology, and medicine, Heidelberg, Springer, (ISBN 978-3-642-45410-3, lire en ligne)
